

Hưng
Giới thiệu về bản thân



































Kích thước của cả khung ảnh là \(\left(\right. 17 + 2 x \left.\right)\) cm x \(\left(\right. 25 + 2 x \left.\right)\) cm (Điều kiện: \(x > 0\))
Diện tích cả khung ảnh là: S = \(\left(\right. 17 + 2 x \left.\right) . \left(\right. 25 + 2 x \left.\right) = 4 x^{2} + 84 x + 425\)
Để diện tích của cả khung ảnh lớn nhất là \(513\) cm2 thì \(S = 4 x^{2} + 84 x + 425 \leq 513\)
\(\Rightarrow 4 x^{2} + 84 x - 88 \leq 0 \Leftrightarrow - 22 \leq x \leq 1\). Vì \(x > 0\) nên \(x \in \left(\right. 0 ; 1 \left]\right.\)
Vậy cần phải làm độ rộng viền khung ảnh tối đa \(1\) (cm).
a)
\(& \overset{\rightarrow}{n_{\Delta}} = \left(\right. 3 ; 4 \left.\right) ; \\ & \overset{\rightarrow}{n_{\Delta_{1}}} = \left(\right. 5 ; - 12 \left.\right) .\)
\(cos \alpha = \mid cos \left(\right. \overset{\rightarrow}{n_{\Delta}} ; \overset{\rightarrow}{n_{\Delta_{1}}} \left.\right) \mid = \frac{\mid 3.5 + 4. \left(\right. - 12 \left.\right) \mid}{5.13} = \frac{33}{65}\).
b) \(\left(\right. C \left.\right)\) có tâm \(I \left(\right. 3 ; - 2 \left.\right)\), bán kính \(R = 6\)
Đường thẳng \(d\) có dạng \(4 x - 3 y + m = 0\) (\(m\) khác \(7\))
\(d\) tiếp xúc \(\left(\right. C \left.\right)\) khi và chỉ khi \(d \left(\right. I , d \left.\right) = R \Leftrightarrow \frac{\mid 12 + 6 + m \mid}{5} = 6\).
Tìm được \(m = - 48\)(TM), \(m = 12\) (TM)
Vậy có hai đường thẳng \(d\) thỏa mãn là \(4 x - 3 y - 48 = 0\) và \(4 x - 3 y + 12 = 0\).
a) Ta có \(f \left(\right. x \left.\right) = x^{2} + 2 \left(\right. m - 1 \left.\right) x + m + 5\) có \(\Delta^{'} = \left(\right. m - 1 \left.\right)^{2} - \left(\right. m + 5 \left.\right) = m^{2} - 3 m - 4\)
Lại có hệ số \(a = 1 > 0\).
Để \(f \left(\right. x \left.\right)\) luôn dương (cùng dấu hệ số \(a\)) với mọi \(x \in \mathbb{R}\) thì \(\Delta^{'} < 0\) \(\Leftrightarrow m^{2} - 3 m - 4 < 0\).
Xét tam thức \(h \left(\right. m \left.\right) = m^{2} - 3 m - 4\) có \(\Delta_{m} = 9 - 4. \left(\right. - 4 \left.\right) = 25 > 0\) nên \(h \left(\right. m \left.\right)\) có hai nghiệm là \(m_{1} = - 1\) và \(m_{2} = 4\).
Ta có bảng xét dấu của \(h \left(\right. m \left.\right)\):
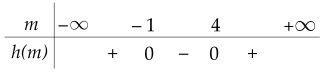
Do đó \(h \left(\right. m \left.\right) < 0\) với mọi \(x \in \left(\right. - 1 ; 4 \left.\right)\)
Hay \(\Delta^{'} < 0\) với mọi \(x \in \left(\right. - 1 ; 4 \left.\right)\)
Vậy \(x \in \left(\right. - 1 ; 4 \left.\right)\) thì tam thức bậc hai \(f \left(\right. x \left.\right) = x^{2} + \left(\right. m - 1 \left.\right) x + m + 5\) dương với mọi \(x \in \mathbb{R}\).
b) Bình phương hai vế ta được: \(2 x^{2} - 8 x + 4 = x^{2} - 4 x + 4\)
\(\Leftrightarrow x^{2} - 4 x = 0\)
Suy ra \(x = 0\) hoặc \(x = 4\)
Thử lại nghiệm được \(x = 4\) thỏa mãn phương trình.
Vậy tập nghiệm \(S = 4\).
Phương trình phản ứng:
Với Zn:
Zn+2H2SO4→ZnSO4+SO2+2H2OZn + 2H_2SO_4 \to ZnSO_4 + SO_2 + 2H_2OZn+2H2SO4→ZnSO4+SO2+2H2O
Với Al:
2Al+6H2SO4→Al2(SO4)3+3SO2+6H2O2Al + 6H_2SO_4 \to Al_2(SO_4)_3 + 3SO_2 + 6H_2O2Al+6H2SO4→Al2(SO4)3+3SO2+6H2O
Bước 1: Tính số mol SO₂ sinh ra
nSO2=5,622,4=0,25 moln_{SO_2} = \frac{5,6}{22,4} = 0,25 \text{ mol}nSO2=22,45,6=0,25 mol
Gọi xxx và yyy lần lượt là số mol của Al và Zn.
Tổng khối lượng hỗn hợp:
27x+65y=9,227x + 65y = 9,227x+65y=9,2
Tổng số mol SO₂ tạo ra:
3x+y=0,253x + y = 0,253x+y=0,25
Bước 2: Giải hệ phương trình
27x+65y=9,227x + 65y = 9,227x+65y=9,2 3x+y=0,253x + y = 0,253x+y=0,25
Từ phương trình thứ hai:
y=0,25−3xy = 0,25 - 3xy=0,25−3x
Thay vào phương trình thứ nhất:
27x+65(0,25−3x)=9,227x + 65(0,25 - 3x) = 9,227x+65(0,25−3x)=9,2 27x+16,25−195x=9,227x + 16,25 - 195x = 9,227x+16,25−195x=9,2 −168x+16,25=9,2-168x + 16,25 = 9,2−168x+16,25=9,2 −168x=−7,05-168x = -7,05−168x=−7,05 x=0,042 molx = 0,042 \text{ mol}x=0,042 mol
Bước 3: Tính khối lượng Al
mAl=0,042×27=1,134 gm_{Al} = 0,042 \times 27 = 1,134 \text{ g}mAl=0,042×27=1,134 g
Đáp số: 1,134 g Al.
a) Tính biến thiên enthalpy chuẩn của phản ứng
Cách 1: Dựa vào nhiệt tạo thành chuẩn
Công thức tính:
ΔHphảnứng=∑ΔHsảnphẩm−∑ΔHphảnứng\Delta H_{phản ứng} = \sum \Delta H_{sản phẩm} - \sum \Delta H_{phản ứng}ΔHphảnứng=∑ΔHsảnphẩm−∑ΔHphảnứng
Thay số liệu vào:
ΔH=[3(−393,50)+4(−241,82)]−[(−105,00)+5(0)]\Delta H = [3(-393,50) + 4(-241,82)] - [(-105,00) + 5(0)]ΔH=[3(−393,50)+4(−241,82)]−[(−105,00)+5(0)] =[−1180,50−967,28]−(−105,00)= [ -1180,50 - 967,28] - (-105,00)=[−1180,50−967,28]−(−105,00) =−2142,78+105,00= -2142,78 + 105,00=−2142,78+105,00 =−2037,78 kJ= -2037,78 \text{ kJ}=−2037,78 kJ
Cách 2: Dựa vào năng lượng liên kết
Công thức tính:
ΔHphảnứng=∑Elie^nke^ˊtbịphaˊ−∑Elie^nke^ˊttạothaˋnh\Delta H_{phản ứng} = \sum E_{liên kết bị phá} - \sum E_{liên kết tạo thành}ΔHphảnứng=∑Elie^nke^ˊtbịphaˊ−∑Elie^nke^ˊttạothaˋnh
Tính tổng năng lượng liên kết bị phá (phản ứng cần cung cấp năng lượng để phá vỡ liên kết trong chất phản ứng):
- Propane C₃H₈:
- 8 liên kết C-H: 8×418=33448 \times 418 = 33448×418=3344 kJ
- 2 liên kết C-C: 2×346=6922 \times 346 = 6922×346=692 kJ
- O₂:
- 5 liên kết O=O: 5×494=24705 \times 494 = 24705×494=2470 kJ
Ephaˊ=3344+692+2470=6506 kJE_{phá} = 3344 + 692 + 2470 = 6506 \text{ kJ}Ephaˊ=3344+692+2470=6506 kJ
Tính tổng năng lượng liên kết được tạo thành (phản ứng giải phóng năng lượng khi tạo liên kết trong sản phẩm):
- CO₂:
- 6 liên kết C=O: 6×732=43926 \times 732 = 43926×732=4392 kJ
- H₂O:
- 8 liên kết O-H: 8×459=36728 \times 459 = 36728×459=3672 kJ
Etạo=4392+3672=8064 kJE_{tạo} = 4392 + 3672 = 8064 \text{ kJ}Etạo=4392+3672=8064 kJ
Tính ΔHphảnứng\Delta H_{phản ứng}ΔHphảnứng:
ΔH=6506−8064=−1558 kJ\Delta H = 6506 - 8064 = -1558 \text{ kJ}ΔH=6506−8064=−1558 kJ
b) So sánh hai giá trị và giải thích sự khác biệt
- Giá trị từ nhiệt tạo thành: -2037,78 kJ
- Giá trị từ năng lượng liên kết: -1558 kJ
- Có sự khác biệt giữa hai giá trị.
Giải thích sự khác biệt:
- Nhiệt tạo thành chuẩn (ΔHf∘\Delta H_f^\circΔHf∘) được đo thực nghiệm, bao gồm các yếu tố như pha của các chất (khí, lỏng, rắn) và hiệu ứng bức xạ nhiệt.
- Năng lượng liên kết chỉ là giá trị trung bình, có thể không chính xác hoàn toàn trong từng hợp chất cụ thể.
- Trong cách tính bằng năng lượng liên kết, chưa tính đến yếu tố như cấu trúc phân tử, hiệu ứng cộng hưởng hoặc năng lượng bề mặt.
⟶ Kết luận: Giá trị từ nhiệt tạo thành chính xác hơn vì nó dựa trên dữ liệu thực nghiệm.
-
NH₃ + O₂ → NO + H₂O
PTHH cân bằng:
4NH3+5O2→4NO+6H2O4NH_3 + 5O_2 \to 4NO + 6H_2O4NH3+5O2→4NO+6H2O -
Cu + HNO₃ → Cu(NO₃)₂ + NO + H₂O
PTHH cân bằng:
3Cu+8HNO3→3Cu(NO3)2+2NO+4H2O3Cu + 8HNO_3 \to 3Cu(NO_3)_2 + 2NO + 4H_2O3Cu+8HNO3→3Cu(NO3)2+2NO+4H2O -
Mg + HNO₃ → Mg(NO₃)₂ + NH₄NO₃ + H₂O
PTHH cân bằng:
4Mg+10HNO3→4Mg(NO3)2+NH4NO3+3H2O4Mg + 10HNO_3 \to 4Mg(NO_3)_2 + NH_4NO_3 + 3H_2O4Mg+10HNO3→4Mg(NO3)2+NH4NO3+3H2O -
Zn + H₂SO₄ → ZnSO₄ + H₂S + H₂O
PTHH cân bằng:
4Zn+5H2SO4→4ZnSO4+H2S+4H2O4Zn + 5H_2SO_4 \to 4ZnSO_4 + H_2S + 4H_2O4Zn+5H2SO4→4ZnSO4+H2S+4H2O
Phương trình phản ứng:
Fe+2H2SO4→FeSO4+SO2+2H2OFe + 2H_2SO_4 \to FeSO_4 + SO_2 + 2H_2OFe+2H2SO4→FeSO4+SO2+2H2O
Số mol SO₂:
nSO2=3,3622,4=0,15 moln_{SO_2} = \frac{3,36}{22,4} = 0,15 \text{ mol}nSO2=22,43,36=0,15 mol
Theo PTHH, số mol Fe phản ứng:
nFe=nSO2=0,15 moln_{Fe} = n_{SO_2} = 0,15 \text{ mol}nFe=nSO2=0,15 mol
Khối lượng Fe:
m=nFe×MFe=0,15×56=8,4 gm = n_{Fe} \times M_{Fe} = 0,15 \times 56 = 8,4 \text{ g}m=nFe×MFe=0,15×56=8,4 g
Khối lượng muối FeSO₄ tạo thành:
mFeSO4=nFe×MFeSO4=0,15×152=22,8 gm_{FeSO_4} = n_{Fe} \times M_{FeSO_4} = 0,15 \times 152 = 22,8 \text{ g}mFeSO4=nFe×MFeSO4=0,15×152=22,8 g
Đáp số:
a) m=8,4m = 8,4m=8,4 g
b) mFeSO4=22,8m_{FeSO_4} = 22,8mFeSO4=22,8 g
a) Khi ở nơi đông người trong không gian kín, lượng O₂ giảm do quá trình hô hấp của con người, đồng thời CO₂ tăng lên. Khi nồng độ O₂ thấp, cơ thể không nhận đủ oxy để hô hấp hiệu quả, dẫn đến cảm giác khó thở. Để bù đắp, nhịp thở tăng lên nhằm cung cấp nhiều oxy hơn cho cơ thể.
b) Tàn đóm đỏ bùng lên khi đưa vào bình oxygen nguyên chất vì O₂ là chất duy trì sự cháy rất mạnh. Khi gặp môi trường giàu O₂, than hồng sẽ cháy mạnh hơn do phản ứng C + O₂ → CO₂ xảy ra nhanh hơn, giải phóng nhiều nhiệt hơn, làm tàn đóm bùng sáng.