cho 1mol nhôm dư vào 200ml dd cuso4 0,1M .Khi phản ứng sảy ra hoàn toàn , tính kl của đồng và nhôm
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a,\) Đặt \(n_{CuSO_4}=x(mol)\)
\(PTHH:2Al+3CuSO_4\to Al_2(SO_4)_3+3Cu\\ \dfrac{2}{3}x.....x......\dfrac{1}{3}x.....x(mol)\\ \Rightarrow \Delta m_{Al\uparrow}=m_{Cu}-m_{Al}=64x-\dfrac{2}{3}.27x=1,38\\ \Rightarrow x=0,03\\ \Rightarrow m_{Cu}=0,03.64=1,92(g)\\ b,n_{CuSO_4}=0,03(mol)\\ \Rightarrow C_{M_{CuSO_4}}=\dfrac{0,03}{0,2}=0,15M\)
Gọi khối lượng Al ban đầu là a gam
khối lượng Al pư là x gam
PTHH: 2Al+3CuSO4→Al2(SO4)3+3Cu
a, vì khối lượng của nhôm sau pư tăng 1,38g, nên ta có PT:
(a-x) + 192x/54 = a + 1,38
⇒ x= 0,54
⇒ a= 0,54 + 1,38 = 1,92g
b, nAl=0,54/27 = 0,02 mol
theo PTHH có nCuSO4=2/3 .nAl = 0,03 mol
⇒CMCuSO4=0,03/0,2=0,15M
Chúc bạn học tốt nha!

a. 2Al + 3 \(CuSO_4\)→ 1 \(Al_2\left(SO_4\right)_3+3Cu\)
0.45 0,3375 (mol)
⇔0,225.2 0,1125.3 (mol)
0,3375 -----→ \(\dfrac{0,3375.1}{3}\)=0,1125 (mol)
(lấy số mol lớn - số mol bé ➙ số mol dư)
b. \(n_{Al}\)= \(\dfrac{12,15}{27}\)=0,45 (mol)
\(n_{CuSO_4}\)= \(\dfrac{54}{64+32+16.4}\)=0,3375(mol)
➝ \(n_{Al}\)dư= 0,1125 (mol)
⇒\(m_{Al_{dư}}\)= 0,1125.27=3.0375(gam)
⇒\(m_{Al_2\left(SO_4\right)_3}\)= 0,1125. \(\left[27.2+2\left(32+16.4\right)\right]\)=27,675(gam)

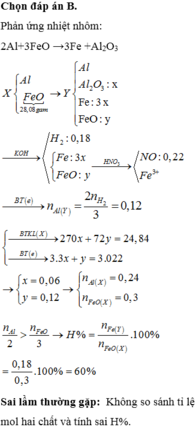
Đáp án B
∙ C á c h 1 : T í n h t h e o p h ư ơ n g t r ì n h p h ả n ứ n g 2 A l + 3 C uS O 4 A l 2 ( S O 4 ) 3 + 3 C u ↓ ⇒ n C u = n C u S O 4 = 0 , 02 m o l ⇒ m C u = 1 , 28 g a m ∙ C á c h 2 : S ử d ụ n g b ả o t o à n n g u y ê n t ố B T N T C u : n C u = n C u S O 4 = 0 , 02 m o l ⇒ m C u = 1 , 28 g a m

\(n_{O_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,4 0,3 0,2 ( mol )
\(n_{H_2}=\dfrac{6,72}{22,4}=0,3mol\)
\(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\) ( không giải phóng H2)
=> Chất rắn tạo ra H2 là Al
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)
0,2 0,3 ( mol )
\(\Rightarrow m_{Al}=\left(0,2.27\right)+\left(0,4.27\right)=16,2g\)

\(a,PTHH:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\\ n_{Al}=\dfrac{m}{M}=\dfrac{10,8}{27}=0,4\left(mol\right)\\ Theo.PTHH:n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,4=0,2\left(mol\right)\\ m_{Al_2O_3}=n.M=0,2.102=20,4\left(g\right)\)
\(b,n_{O_2}=\dfrac{V_{\left(đktc\right)}}{22,4}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\\ Lập.tỉ.lệ:\dfrac{n_{Al}}{4}>\dfrac{n_{O_2}}{3}\Rightarrow Al.dư\\ Theo.PTHH:n_{Al\left(pư\right)}=\dfrac{4}{3}.n_{O_2}=\dfrac{4}{3}.0,2\left(mol\right)\\ n_{Al\left(dư\right)}=n_{Al\left(bđ\right)}-n_{Al\left(pư\right)}=0,4-0,2=0,2\left(mol\right)\\ Theo.PTHH:n_{Al_2O_3}=\dfrac{1}{2}.n_{Al}=\dfrac{1}{2}.0,2=0,1\left(mol\right)\\ m_{Al_2O_3}=n.M=0,1=102=10,2\left(g\right)\)

a)
PTHH: 2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
______a--------------------------------->1,5a
=> 5 - 27a + 64.1,5a = 5,69
=> a = 0,01
=> nCu = 0,015(mol)
=> mCu = 0,015.64 = 0,96 (g)
b) nCuSO4 = 0,25.0,4 = 0,1 (mol)
PTHH: 2Al + 3CuSO4 --> Al2(SO4)3 + 3Cu
____0,01--->0,015------->0,005
=> \(\left\{{}\begin{matrix}C_M\left(Al_2\left(SO_4\right)_3\right)=\dfrac{0,005}{0,25}=0,02M\\C_M\left(CuSO_4\right)=\dfrac{0,1-0,015}{0,25}=0,34M\end{matrix}\right.\)

$n_{Al} = 0,2(mol) ; n_{Fe_3O_4} = 0,075(mol)$
$8Al + 3Fe_3O_4 \xrightarrow{t^o} 9Fe + 4Al_2O_3$
Vì $n_{Al} : 8 = n_{Fe_3O_4} : 3$ nên gọi hiệu suất là a
Suy ra: $n_{Al\ pư} = 0,2a(mol) ; n_{Al\ dư} = 0,2 - 0,2a(mol)$
$n_{Fe} = \dfrac{9}{8}n_{Al} = 0,225a(mol)$
Mà :
$n_{H_2} = 1,5n_{Al} + n_{Fe} = 1,5(0,2 - 0,2a) + 0,225a = \dfrac{5,376}{22,4}$
$\Rightarrow a = 0,8 = 80\%$
🧮 Bước 1: Tính số mol CuSO₄
\(n_{C u S O_{4}} = 0 , 1 \times 0 , 2 = 0 , 02 \&\text{nbsp}; m o l\)
⚖️ Bước 2: Viết phương trình phản ứng
\(2 A l + 3 C u S O_{4} \rightarrow A l_{2} \left(\right. S O_{4} \left.\right)_{3} + 3 C u\)
Từ PTHH:
⇒ 1 mol Al → 1.5 mol Cu
⇒ 1 mol Al cần 1.5 mol CuSO₄ để phản ứng hết.
Nhưng thực tế chỉ có 0,02 mol CuSO₄, nên Al dư, và CuSO₄ hết trước (phản ứng xảy ra hoàn toàn theo lượng CuSO₄).
🧮 Bước 3: Tính số mol Cu sinh ra
Từ PTHH:
\(3 C u S O_{4} \rightarrow 3 C u \Rightarrow n_{C u} = n_{C u S O_{4}} = 0 , 02 \&\text{nbsp}; m o l\)
⚖️ Bước 4: Tính khối lượng Cu và Al đã phản ứng
💎 Khối lượng đồng (Cu):
\(m_{C u} = 0 , 02 \times 64 = \boxed{1 , 28 \&\text{nbsp}; g r a m}\)
🔩 Tính số mol Al đã phản ứng:
Từ tỉ lệ: 3 mol Cu ↔ 2 mol Al
\(n_{A l} = \frac{2}{3} \times 0 , 02 = \frac{0 , 04}{3} \approx 0 , 0133 \&\text{nbsp}; m o l\) \(m_{A l} = 0 , 0133 \times 27 \approx \boxed{0 , 36 \&\text{nbsp}; g r a m}\)
✅ Đáp số:
Nhớ like nha
em hổng biết chị ơi