Bài toán 1: Hút chính xác 5,0 ml dung dịch acid acetic cho vào bình định mức 100,0 ml, thêm nước cất vừa đủ, lắc đều. Hút chính xác 10,0 ml dung dịch vừa pha đem chuẩn độ bằng dung dịch natri hydroxyd 0,1N (K = 0,980) hết 8,20 ml.
1.1. Tính nồng độ % của dung dịch acid acetic?
1.2. Nếu dung dịch natri hydroxyd 0,1N có K = 1,000 thì hết bao nhiêu ml?



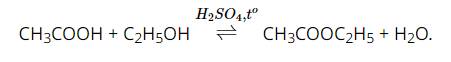
Chào bạn, đây là lời giải chi tiết cho bài toán của bạn:
1.1. Tính nồng độ % của dung dịch acid acetic:
CH₃COOH + NaOH → CH₃COONa + H₂O
1.2. Nếu dung dịch NaOH 0,1N có K = 1,000 thì hết bao nhiêu ml?
Kết luận: