trong phòng thí nghiệm để điều chế khí hydrogen bn nam cho2,24g iron tác dụng với dung dịch HCl tạo thành FeCl2 và có 0,61975 lít khí hydrogen thoát ra ở đkc hãy tính kl các chất thu dc sau p ứng , mọi ng giúp e dc ko ạ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Fe_3O_4}=\dfrac{m_{Fe_3O_4}}{M_{Fe_3O_4}}=\dfrac{4,64}{232}=0,02mol\)
\(3Fe+2O_2\rightarrow\left(t^o\right)Fe_3O_4\)
0,06 0,04 0,02 ( mol )
\(m_{Fe}=n_{Fe}.M_{Fe}=0,06.56=3,36g\)
\(m_{O_2}=n_{O_2}.M_{O_2}=0,04.32=1,28g\)
\(pthh:3Fe+2O_2\overset{t^o}{--->}Fe_3O_4\)
Ta có: \(n_{Fe_3O_4}=\dfrac{4,64}{232}=0,02\left(mol\right)\)
Theo pt: \(n_{Fe}=3.0,02=0,06\left(mol\right)\)
\(\Rightarrow m_{Fe}=0,06.56=3,36\left(g\right)\)
Theo pt: \(n_{O_2}=2.0,02=0,04\left(mol\right)\)
\(\Rightarrow m_{O_2}=0,04.32=1,28\left(g\right)\)

1. Đốt nóng KMnO4 ở t độ cao:
\(2KMnO_4\rightarrow^{t^0}K_2MnO_4+MnO_2+O_2\uparrow\)
2. Cho Zn vào đ HCl thu được:
\(Zn+HCl\rightarrow ZnCl_2+H_2\uparrow\)
3. Thu O2: đẩy kk hoặc đẩy nước (Xem SGK)
Thu H2: đẩy nước hoặc đẩy kk (Xem SGK)
1 , nhiệt phân \(KMnO_4\)
\(2KMnO_4-t^o->K_2MnO_4+MnO_2+O_2\)

Ta có: \(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\)
PT: \(Mg+2HCl\rightarrow MgCl_2+H_2\)
Theo PT: \(n_{HCl}=2n_{Mg}=0,4\left(mol\right)\Rightarrow m_{HCl}=0,4.36,5=14,6\left(g\right)\)
\(n_{H_2}=n_{Mg}=0,2\left(mol\right)\Rightarrow V_{H_2}=0,2.22,4=4,48\left(l\right)\)

\(n_{H_2}=\dfrac{2,479}{24,79}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\uparrow\)
0,1 0,2 0,1 0,1
\(m_{Zn}=0,1.65=6,5\left(g\right)\)

Phương trình hóa học của phản ứng:
Fe + H2SO4 → FeSO4 + H2.
Zn + H2SO4 → ZnSO4 + H2.
Fe + 2HCl → FeCl2 + H2.
Zn + 2HCl → ZnCl2 + H2.
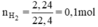
Theo phương trình (3) mFe cần dùng: 56.0,1 = 5,6g.
Theo phương trình (4) mZn cần dùng: 65.0,1 = 6,5g.

\(n_{Fe_3O_4}=\dfrac{m}{M}=\dfrac{6,96}{56\cdot3+16\cdot4}=0,03\left(mol\right)\\ PTHH;3Fe+2O_2-^{t^o}>Fe_3O_4\)
tỉ lệ: 3 : 2 : 1
n(mol) 0,09<-----0,06<---0,03
\(m_{Fe}=n\cdot M=0,09\cdot56=5,04\left(g\right)\\ V_{O_2\left(dktc\right)}=n\cdot22,4=0,06\cdot22,4=1,344\left(l\right)\)

a)\(n_{Fe_3O_4}=\dfrac{11,6}{232}=0,05mol\)
\(3Fe+2O_2\underrightarrow{t^o}Fe_3O_4\)
0,15 0,1 0,05
\(m_{Fe}=0,15\cdot56=8,4g\)
\(m_{O_2}=0,1\cdot32=3,2g\)
b)\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,2 0,1
\(m_{KMnO_4}=0,2\cdot158=31,6g\)
\(a,n_{Fe_3O_4}=\dfrac{11,6}{232}=0,05\left(mol\right)\)
PTHH: 3Fe + 2O2 --to--> Fe3O4
0,15<--0,1<----------0,05
\(\rightarrow\left\{{}\begin{matrix}m_{Fe}=0,15.56=8,4\left(g\right)\\m_{O_2}=0,1.32=3,2\left(g\right)\end{matrix}\right.\)
b, PTHH: 2KMnO4 --to--> K2MnO4 + MnO2 + O2
0,2<--------------------------------------0,1
=> mKMnO4 = 0,2.158 = 31,6 (g)

Đáp án : C
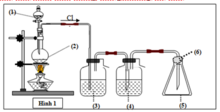
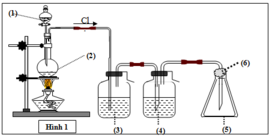
Vì khí là Cl2 cần loại bỏ HCl => (3) và (4) phải chứa dung dịch giữ lại HCl nhưng không ảnh hưởng đến Cl2

\(Zn + 2HCl \to ZnCl_2 + H_2\\ Zn + H_2SO_4 \to ZnSO_4 + H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ Fe + H_2SO_4 \to FeSO_4 + H_2\\ n_{Fe} = n_{Zn} = n_{H_2} = \dfrac{2,24}{22,4} = 0,1(mol)\\ m_{Fe} = 0,1.56 = 5,6(gam) ; m_{Zn} = 0,1.65 = 6,5(gam)\)