Hoà tan hỗn hợp gồm 0,93 gam Zn và Fe trong dung dịch H2SO4 9,8% chứng minh hỗn hợp vẫn còn dư acid SOS lẹ mọi người ơi hu hu
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{H_2}=n_{H_2SO_4}=\dfrac{11.2}{22.4}=0.5\left(mol\right)\)
\(BTKL:\)
\(m_{Muối}=17.5+0.5\cdot98-0.5\cdot2=65.5\left(g\right)\)
Fe+H2SO4→FeSO4+H2Fe+H2SO4→FeSO4+H2
2Al+3H2SO4→Al2(SO4)3+3H22Al+3H2SO4→Al2(SO4)3+3H2
Zn+H2SO4→ZnSO4+H2Zn+H2SO4→ZnSO4+H2
nH2=11,222,4=0,5(mol)nH2=11,222,4=0,5(mol)
Theo 3PTHH trên: nH2=nH2SO4=0,5(mol)nH2=nH2SO4=0,5(mol)
a) VddH2SO4=0,50,5=1M

n H 2 = 1,344/22,4 = 0,06
n H 2 SO 4 = n H 2 = 0,060
n SO 4 2 - = n H 2 SO 4 = 0,06
m muối = m kim loại + m SO 4 2 - = 3,22 + 0,06 x 96 = 8,98g

PTHH chung: M + H2SO4 MSO4 + H2
nHSO = nH= = 0,06 mol
áp dụng định luật BTKL ta có:
mMuối = mX + m HSO- m H= 3,22 + 98 * 0,06 - 2 * 0,06 = 8,98g
M + H2SO4 ---> MSO4 + H2 (M la` Fe, Mg, Zn)
--> nSO4(2-) = nH2SO4 = nH2 = 1.344/22.4 = 0.06
--> mmuoi' = mKL + mSO4(2-) = 3.22 + 0.06*96 = 8.98g

a. Có các phản ứng hóa học xảy ra:
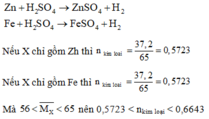
Ta có: n H 2 S O 4 phản ứng = nkim loại < 0,6643
Mà: n H 2 S O 4 ban đầu = 1 > 0,6643 nên sau phản ứng kim loại tan hết, axit còn dư.
b. Khi sử dụng lượng X gấp đôi thì 0,5723.2 < nkim loại < 0,6643.2
Hay 1,1446 < nkim loại < 1,3286
Mà nếu các kim loại bị hòa tan hết thì n H 2 S O 4 phản ứng = nkim loại > 1,1446
Do n H 2 S O 4 thực tế = 1 < 1,1446 nên sau phản ứng kim loại chưa tan hết.
Đán án A

Đáp án A
Số mol các chất là:
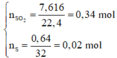
Sơ đồ phản ứng:
Al Zn ⏟ 11 , 9 g a m + H 2 S O 4 ( đ ặ c ) → Al 2 ( SO 4 ) 3 ZnSO 4 ⏟ M u ố i + S O 2 ⏟ 0 , 34 mol S ⏟ 0 , 02 m o l + H 2 o
Áp dụng công thức của bài toán kim loại tác dụng với H2SO4 đặc ta có:
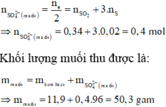
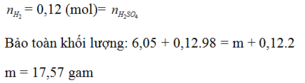
Số mol của Zn: n(Zn) = 0,93 g / 65,38 g/mol ≈ 0,0142 mol.
Số mol của Fe: n(Fe) = 0,93 g / 55,85 g/mol ≈ 0,0166 mol.
Khối lượng H2SO4 trong 100 g dung dịch = 9,8 g.
Số mol H2SO4:
n(H2SO4) = 9,8 g / 98 g/mol ≈ 0,1 mol.
Zn + H2SO4 → ZnSO4 + H2↑.
Phản ứng giữa Fe và H2SO4: Fe + H2SO4 → FeSO4 + H2↑.
Từ phương trình phản ứng, ta thấy rằng 1 mol Zn và 1 mol Fe cần 1 mol H2SO4. Tổng số mol H2SO4 cần cho cả Zn và Fe là: n(H2SO4 cần) = n(Zn) + n(Fe) = 0,0142 mol + 0,0166 mol = 0,0308 mol.
Số mol H2SO4 có trong dung dịch là 0,1 mol, trong khi số mol H2SO4 cần chỉ là 0,0308 mol.
Vậy, số mol H2SO4 còn dư là: n(H2SO4 dư) = n(H2SO4 có) - n(H2SO4 cần) = 0,1 mol - 0,0308 mol = 0,0692 mol.