ỘT BÌNH CÓ DUNG DỊCH L;À 1800 CM3 ĐANG CHỨA NƯỚC Ở MỨC 1/3 THỂ TÍCH CỦA BÌNH. KHI THẢ HÒN ĐÁ VÀO , MỨC NƯỚC TRONG BÌNH DÂNG LÊN THỂ TÍCH 1200 CM3 CỦA BÌNH . HÃY XÁC ĐỊNH THỂ TÍCH HÒN ĐÁ
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


bình \(1\) chứa số lít \(H_2SO4\) nguyên chất là : \(10.70\%=7l\)
gọi số lít từ bình \(2\) cần đổ sang là \(a\left(l\right)\)
có : sau khi đổ thì bình 1 có nồng độ \(H_2SO4\) là \(80\%\)
\(\Rightarrow\) \(\dfrac{7+0,9a}{10+a}=0,8\) \(\Leftrightarrow\) \(\left\{{}\begin{matrix}7+0,9a=0,8\left(10+a\right)\\7+0,9a=8+0,8a\\a=10\left(l\right)\end{matrix}\right.\) \(\Rightarrow\) \(a=10\) \(lít\)

a)
n KMnO4 = 0,26(mol)
Bảo toàn electron :
5n KMnO4 = 2n SO2
<=> n SO2 = 0,26.5/2 = 0,65(mol)
V SO2 = 0,65.22,4 = 14,56 lít
b)
n H2SO4 pư = 2n SO2 = 0,65.2 = 1,3(mol)
n H2SO4 dư = 1,3.10% = 0,13(mol)
=> n H2SO4 đã dùng = 1,3 + 0,13 = 1,43(mol)
C% H2SO4 = 1,43.98/150 .100% = 93,43%

Đáp án D
Phản ứng điện phân hai dung dịch:

Vì hai bình điện phân mắc nối tiếp nên cường độ dòng điện qua hai bình điện phân là như nhau.
Do đó số mol electron trao đổi ở hai bình điện phân bằng nhau.
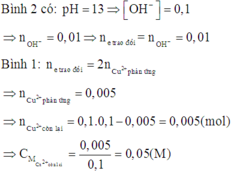

a)
C2H2 + 2AgNO3 + 2NH3 --> C2Ag2 + 2NH4NO3
C3H6 + Br2 --> C3H6Br2
b)
\(n_{C_2Ag_2}=\dfrac{3,6}{240}=0,015\left(mol\right)\)
=> nC2H2 = 0,015 (mol)
\(m_{tăng}=m_{C_3H_6}=2,1\left(g\right)\)
=> \(n_{C_3H_6}=\dfrac{2,1}{42}=0,05\left(mol\right)\)
\(n_{C_2H_6}=\dfrac{0,784}{22,4}=0,035\left(mol\right)\)
\(\left\{{}\begin{matrix}\%V_{C_2H_6}=\dfrac{0,035}{0,035+0,05+0,015}.100\%=35\%\\\%V_{C_3H_6}=\dfrac{0,05}{0,035+0,05+0,015}.100\%=50\%\\\%V_{C_2H_2}=\dfrac{0,015}{0,035+0,05+0,015}.100\%=15\%\end{matrix}\right.\)
\(\left\{{}\begin{matrix}\%m_{C_2H_6}=\dfrac{0,035.30}{0,035.30+0,05.42+0,015.26}.100\%=29,661\%\\\%m_{C_3H_6}=\dfrac{0,05.42}{0,035.30+0,05.42+0,015.26}.100\%=59,322\%\\\%m_{C_2H_2}=\dfrac{0,015.26}{0,035.30+0,05.42+0,015.26}.100\%=11,017\%\end{matrix}\right.\)
c)
\(n_{CaCO_3}=\dfrac{5}{100}=0,05\left(mol\right)\)
Bảo toàn C: \(n_{CaCO_3}+2.n_{Ca\left(HCO_3\right)_2}=0,25\left(mol\right)\)
=> \(n_{Ca\left(HCO_3\right)_2}=0,1\left(mol\right)\)
Bảo toàn Ca: \(n_{Ca\left(OH\right)_2}=0,15\left(mol\right)\)
=> \(V_{dd.Ca\left(OH\right)_2}=\dfrac{0,15}{1}=0,15\left(l\right)=150\left(ml\right)\)

Ta có: \(n_X=\dfrac{3,584}{22,4}=0,16\left(mol\right)\)
- Cho hh khí quá bình 1:
PT: \(C_3H_4+AgNO_3+NH_3\rightarrow AgC_3H_3+NH_4NO_3\)
Ta có: \(n_{AgC_3H_3}=\dfrac{5,88}{147}=0,04\left(mol\right)\)
Theo PT: \(n_{C_3H_4}=n_{AgC_3H_3}=0,04\left(mol\right)\)
- Cho tiếp hh khí còn lại qua bình 2, thấy dd Br2 nhạt màu.
→ Br2 dư, C2H4 pư hết. Khí thoát ra là C3H8.
PT: \(C_2H_4+Br_2\rightarrow C_2H_4Br_2\)
Ta có: \(n_{C_3H_8}=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
a, \(\left\{{}\begin{matrix}\%V_{C_2H_4}=\dfrac{0,16-0,08-0,04}{0,16}.100\%=25\%\\\%V_{C_3H_4}=\dfrac{0,04}{0,16}.100\%=25\%\\\%V_{C_3H_8}=50\%\end{matrix}\right.\)
b, Ta có: \(n_X=\dfrac{1,792}{22,4}=0,08\left(mol\right)\)
\(\Rightarrow X\left\{{}\begin{matrix}n_{C_2H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_4}=0,08.25\%=0,02\left(mol\right)\\n_{C_3H_8}=0,04\left(mol\right)\end{matrix}\right.\) \(\Rightarrow n_{\pi}=n_{C_2H_4}+2n_{C_3H_4}=0,06\left(mol\right)\)
\(n_{Br_2}=0,08.1=0,08\left(mol\right)\)
⇒ nπ < nBr2
→ Br2 dư. Hiện tượng: Dd Br2 nhạt màu dần.
mk cug đang cần gáp bài này