Từ 120kg FeS2 người ta sản xuất được 170kg H2SO4 .tính H% toàn bộ hóa trình .
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Từ 120kg FeS2 có thể sản xuất đc bao nhiêu kg axit H2SO4 98%? Biết hiệu suất của cả quá trình là 80%

$n_{FeS_2} = \dfrac{120}{120} = 1(kmol)$
$n_{FeS_2\ pư} = 1.80\% = 0,8(kmol)$
Bảo toàn nguyên tố với S :
$n_{H_2SO_4} = 2n_{FeS_2\ pư} = 1,6(kmol)$
$m_{dd\ H_2SO_4} = \dfrac{1,6.98}{98\%} = 160(kg)$

Đáp án C.
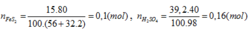
FeS2→ 2H2SO4
0,08 ← 0,16 (mol)
H% = 0,08.100/0,1= 80%

a)
\(4FeS_2 + 11O_2 \xrightarrow{t^o} 2Fe_2O_3 + 4SO_2\\ 2SO_2 + O_2 \xrightarrow{t^o,V_2O_5} 2SO_3\\ SO_3 + H_2O \to H_2SO_4\)
b)
\(m_{FeS_2} = 1000.60\% = 600(kg)\\ n_{FeS_2} = \dfrac{600}{120} = 5(kmol)\\ \Rightarrow n_{FeS_2\ pư} = 5.80\% = 4(kmol)\)
Bảo toàn nguyên tố với S : \(n_{H_2SO_4} = 2n_{FeS_2} = 4.2 = 8(kmol)\)
Suy ra :
\(m_{H_2SO_4} = 8.98 = 784(kg)\\ \Rightarrow m_{dd\ H_2SO_4} = \dfrac{784}{98\%} =800(kg)\)

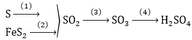

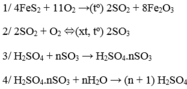
Quá trình sản xuất từ \(FeS_2\rightarrow H_2SO_4\)
\(n_{FeS_2}=\dfrac{120}{120}=1\left(mol\right)\\ BTnguyêntố\left(S\right)\Rightarrow n_{FeS_2}.2=n_{H_2SO_4\left(lt\right)}.1\\ \Rightarrow n_{H_2SO_4\left(lt\right)}=2\left(mol\right)\\ \Rightarrow H=\dfrac{m_{H_2SO_4\left(tt\right)}}{m_{H_2SO_4\left(lt\right)}}.100=\dfrac{170}{2.98}.100=86,74\%\)
4FeS2+11O2-to>2Fe2O3+8SO2
1-------------------------------------2
2SO2+O2-to>V2O5-to>2SO3
2------------------------------2
SO3+H2O->H2SO4
2-------------------2
=>m H2SO4=2.98=196g
=>H=\(\dfrac{170}{196}100=86,73\%\)