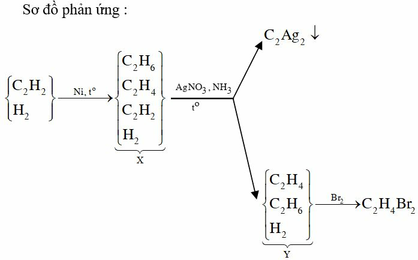
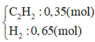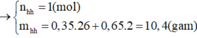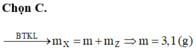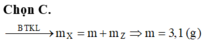Trong một bình kín chứa hỗn hợp X gồm 0,35 mol C2H2; 0,65 mol H2 và một ít bột Ni. Nung nóng bình một thời gian, thu được hỗn hợp khí Y có tỉ khối so với H2 bằng 8. Sục Y vào lượng dư dung dịch AgNO3 trong NH3 đến phản ứng hoàn toàn, thu được hỗn hợp khí Z và 24 gam kết tủa. Hỗn hợp khí Z phản ứng vừa đủ với bao nhiêu mol Br2 trong dung dịch?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Đáp án A
Trong một bình kín chứa 0,35 mol C2H2; 0,65 mol H2 và một ít bột Ni.
Nung bình → hhX có dX/H2 = 8.
Theo BTKL: mhhX = mhh ban đầu = 0,35 x 26 + 0,65 x 2 = 10,4 gam
→ nhhX = 10,4 : 16 = 0,65 mol.
→ nH2phản ứng = nhh ban đầu - nX = 0,35 + 0,65 - 0,65 = 0,35 mol.
Ta có: nπ trước phản ứng = 2 x nCH≡CH = 2 x 0,35 = 0,7 mol.
→ nπ dư = nπ trước phản ứng - nH2 = 0,7 - 0,35 = 0,35 mol.
• Ta có nπ dư = 2 x nAgC≡CAg + nBr2
→ nBr2 = 0,35 - 2 x (12 : 240) = 0,25 mol

Chọn đáp án A
Để làm nhanh bọn hidrocacbon kiểu này các em nhớ là muốn biến bọn hidrocacbon đói thành no phải cho nó ăn H2 hoặc Br2.Và một mol liên kết π cần 1 mol H2 hoặc Br2
![]()
![]()
![]()

Đáp án A
Có nH2 phản ứng = nX-nY = 0,1 + 0,2 + 0,7 - 0,8 = 0,2 mol
ènBr2 phản ứng = nC2H4 + 2nC2H2 - nH2 phản ứng = 0,1 + 2.0,2 - 0,2 = 0,3 mol
èa =
0
,
3
0
,
1
= 3 lít