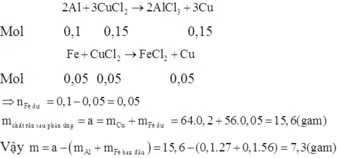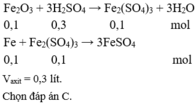Cho 0,1 mol Fe; 0,15 mol Fe(NO3)2 và m gam Al tan hết trong dung dịch HCl. Sau phản ứng thu được 2,352 lít (đktc) hỗn hợp khí X gồm NO và N2O có tỷ khổi so với H2 là 16, dung dịch Y chỉ chứa 47,455 gam muối trung hòa. Cho NaOH dư vào Y thì thấy có 0,82 mol NaOH phản ứng. Biết các phản ứng hoàn toàn. Cho AgNO3 dư vào Y thu được bao nhiêu gam kết tủa?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

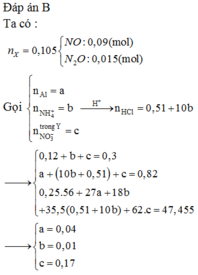
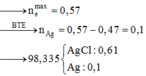

Chọn đáp án A
(1) 0,lmol Fe và 0,1 mol Fe3O4; Có F e + 2 F e 3 + → 3 F e 2 +
(2) 0,lmol FeS và 0,1 mol CuS; Không vì CuS không tan trong axit loãng
(3) 0,1 mol Cu và 0,1 mol Fe3O4; Có C u + F e 3 + → 2 F e 2 + + C u 2 +
(4) 0,02 mol Cu và 0,5 mol Fe(NO3)2; Có
(5) 0,1 mol MgCO3 và 0,1 mol FeCO3. Có

Chọn đáp án A
Với bài toán kim loại tác dụng với muối các bạn cứ quan niệm là kim loại mạnh nhất sẽ đi nuốt anion của thằng yếu nhất trước.
Ta có
![]()
lượng NO3 này sẽ phân bổ dần cho:
Đầu tiên
![]()
![]()
Và Cu + Ag bị cho ra ngoài hết
![]()

Đáp án B
NaOH + HCl→NaCl + H2O
0,1 0,1
3NaOH + Fe(NO3)3→ Fe(OH)3+ 3NaNO3
(0,31-0,1) 0,07 0,07
mFe(OH)3= 0,07.107= 7,49 gam

a, \(\overline{M}=\dfrac{0,1.44+0,2.28}{0,1+0,2}\approx33,33\left(g/mol\right)\)
b, \(\overline{M}=\dfrac{0,2.28+0,3.2}{0,2+0,3}=12,4\left(g/mol\right)\)
c, \(\overline{M}=\dfrac{0,1.28+0,2.30+0,2.44}{0,1+0,2+0,2}=35,2\left(g/mol\right)\)
d, \(\overline{M}=\dfrac{0,2.56+0,1.24+0,1.27}{0,2+0,1+0,1}=40,75\left(g/mol\right)\)

PTHH: \(Fe+S\xrightarrow[]{t^o}FeS\)
Xét tỉ lệ: \(\dfrac{0,2}{1}>\dfrac{0,1}{1}\) \(\Rightarrow\) Fe còn dư, tính theo S
\(\Rightarrow n_{FeS}=0,1\left(mol\right)=n_{Fe\left(dư\right)}\) \(\Rightarrow\left\{{}\begin{matrix}m_{FeS}=0,1\cdot88=8,8\left(g\right)\\m_{Fe\left(dư\right)}=0,1\cdot56=5,6\left(g\right)\end{matrix}\right.\)