Cho Zn dư vào dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối, 01,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu trong không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị gần nhất của m là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

(1). Cho Ca(HCO3)2 vào dung dịch Ca(OH)2.
(3). Cho dung dịch Ba(OH)2 (dư) vào dung dịchAl2(SO4)3.
(6). Cho dung dịch NaOH vào dung dịch MgCl2
ĐÁP ÁN C

Chọn A
Có 2 thí nghiệm thu được chất rắn là (2) và (4)
(1) HCl sẽ hòa tan hết FeS vì FeS + 2HCl → FeCl2 + H2S
(2) Cr không phản ứng với H2SO4 đặc nguội → Vẫn còn Cr kim loại ở thể rắn
(3) Phản ứng có xảy ra giữa H+, NO3– và Fe2+ nhưng không có sản phẩm nào là chất rắn
(4) Có Ag là chất rắn kết tủa vì Ag+ + Fe2+ → Ag + Fe3+
(5) Fe3+ dư nên Zn không thể còn tồn tại và không có Fe vì Fe có sinh ra cũng tan trong Fe3+.

\(n_{H_2}=\dfrac{3.36}{22.4}=0,15\left(mol\right)\)
PTHH : Zn + 2HCl -> ZnCl2 + H2 ( 1)
0,15 0,15
PTHH : 2Al + 6HCl -> 2AlCl3 + 3H2 ( 2 )
0,1 0,15
\(m_{Zn}=0,15.65=9,75\left(g\right)\)
\(m_{Al}=27.0,1=2,7\left(g\right)\)
\(m_{hh}=9,75+2,7=12,45\left(g\right)\)
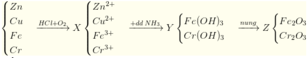
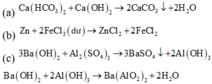

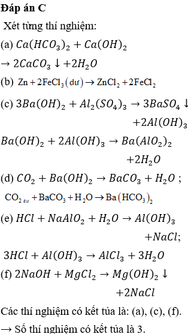
Đáp án B
NO3- phản ứng hết
Giả sử nNH4+ = x mol
+ BTNT N: nNH4++nNO = nNaNO3+nKNO3 => x+0,1 = 0,05+0,1 => x=0,05 mol
+ BT electron => nZn = (3nNO+2nH2+8nNH4+)/2=(3.0,1+2.0,025+8.0,05)/2=0,375 mol
+ BTĐT: nCl-=(2nZn2+ + nNa+ + nK+ + nNH4+) = (2.0,375+0,05+0,1+0,05)=0,95 mol
Dung dịch X gồm:
0,375 mol Zn2+
0,05 mol Na+
0,1 mol K+
0,05 mol NH4+
0,95 mol Cl-
=>m=0,375.65+0,05.23+0,1.39+0,05.18+0,95.35,5=64,05 g