Cho Zn tới dư vào dung dịch gồm HCl; 0,05 mol NaNO3 và 0,1 mol KNO3. Sau khi kết thúc các phản ứng thu được dung dịch X chứa m gam muối; 0,125 mol hỗn hợp khí Y gồm hai khí không màu, trong đó có một khí hóa nâu ngoài không khí. Tỉ khối của Y so với H2 là 12,2. Giá trị của m gần nhất với:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

$n_{HCl} = 0,3(mol) ; n_{CO_2} = 0,05(mol)$
\(CO_3^{2-}+H^+\rightarrow HCO_3^-\)
0,25.......0,25..........................(mol)
\(HCO_3^-+H^+\text{→}CO_2+H_2O\)
0,05........0,05....0,05........................(mol)
Gọi $n_{Na_2CO_3} = a(mol) ; n_{K_2CO_3} = b(mol) \Rightarrow 106a + 138b = 31,3(1)$
Ta có :
$n_{CO_3^{2-}} = a + b = 0,25(2)$
Từ (1)(2) suy ra a = 0,1 ;b = 0,15
$m_{K_2CO_3} = 0,15.138 = 20,7(gam)$

Đáp án D
![]()
Do CuCl2 dư nên kim loại phản ứng hết, X có Cu và HNO3 dư nên Cu cũng phản ứng hết
![]()
⇒ 3.a = 0,15 ⇒ a = 0,05

Gọi \(n_{Zn}=a\left(mol\right)\rightarrow n_{Fe}=1,6a\left(mol\right)\)
Theo đề bài: \(65a+1,6a.56=7,73\rightarrow a=0,05\left(mol\right)\)
\(\rightarrow\left\{{}\begin{matrix}n_{Zn}=0,05\left(mol\right)\\n_{Fe}=0,05.1,6=0,08\left(mol\right)\end{matrix}\right.\)
PTHH:
Zn + 2HCl ---> ZnCl2 + H2
0,05 0,1 0,05 0,05
Fe + 2HCl ---> FeCl2 + H2
0,08 0,16 0,08 0,08
\(\rightarrow V_{H_2}=\left(0,05+0,08\right).22,4=2,912\left(l\right)\)
Gọi mE = a (g)
=> \(\left\{{}\begin{matrix}m_{Fe_2O_3}=48\%.a=0,48a\left(g\right)\\m_{CuO}=32\%.a=0,32a\left(g\right)\end{matrix}\right.\rightarrow\left\{{}\begin{matrix}n_{Fe_2O_3}=\dfrac{0,48a}{160}=0,003a\left(mol\right)\\n_{CuO}=\dfrac{0,32a}{80}=0,004a\left(mol\right)\end{matrix}\right.\)
PTHH:
Fe2O3 + 3H2 --to--> 2Fe + 3H2O
0,003a->0,009a
CuO + H2 --to--> Cu + H2O
0,004a->0,004a
\(\rightarrow0,13=0,004a+0,009a\\ \Leftrightarrow a=100\left(g\right)\)

Đáp án C
Phản ứng xảy ra theo thứ tự:
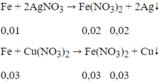
⇒ Fe tan hết
m = 0,02.108 + 0,03.64 = 4,08 (g)

Đáp án C
Phản ứng xảy ra theo thứ tự:
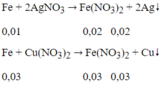
⇒ Fe tan hết
m = 0,02.108 + 0,03.64 = 4,08 (g)

nNa2CO3 = 0,1
Nếu không có khí thoát ra ( nHCl < nNa2CO3 )
mddHCl = 347,8 – 200 = 147,8
⟹ nHCl = 0,1478: Không thỏa mãn điều kiện, loại.
Vậy phải có khí thoát ra.
nHCl = x ⟹nCO2 = x – 0,1
Bảo toàn khối lượng:
36,5x/3,65% + 200 = 347,8 + 44 (x – 0,1 )
⟹ x = 0,15
MY= 24,4 → Y chứa H2. Khí không màu hóa nâu ngoài không khí là NO → Y chứa NO và H2.
Gọi x và y lần lượt là số mol của H2 và NO
Ta có: x+ y= 0,125; 2x+ 30y= 0,125.24,4 → x= 0,025; y= 0,1
Vì có khí H2 thoát ra và Zn dư → H+ và NO3- hết → Muối thu được là muối clorua
Do nNO3(-)ban đầu= 0,15 mol > nNO= 0,1 mol→ X chứa NH4+
Theo bảo toàn nguyên tố N → nNH4+= 0,15-0,1= 0,05 mol
Theo bảo toàn electron: 2.nZn pứ= 3.nNO+ 8nNH4++ 2nH2= 0,75 mol→ nZn pứ= nZn2+= 0,375 mol
→mmuối= mZnCl2+ mNH4Cl+ mNaCl+ mKCl= 136. 0,375+ 53,5.0,05+ 58,5.0,05+ 74,5.0,1= 64,05 gam
Đáp án A