Dung dịch A có chứa 5 ion: và 0,1 mol Cl- và 0,2 mol . Thêm dần V ml dung dịch 1M vào dung dịch A đến khi thu được lượng kết tủa lớn nhất. V có giá trị là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bảo toàn điện tích :
$2n_{Mg^{2+}} + 2n_{Ca^{2+}} = n_{Cl^-} + n_{NO_3^-} = 0,3(mol)$
$\Rightarrow n_{Mg^{2+}} + n_{Ca^{2+}} = 0,15(mol)$
$Mg^{2+} + CO_3^{2-} \to MgCO_3$
$Ca^{2+} + CO_3^{2-} \to CaCO_3$
$\Rightarrow n_{Na_2CO_3} = n_{CO_3^{2-}} = n_{Mg^{2+}} + n_{Ca^{2+}} = 0,15(mol)$
$\Rightarrow V = \dfrac{0,15}{2} = 0,075(lít)$

Đáp án C
Nhận thấy Mg2+ và H+ không thể tồn tại cùng với CO32-
→Dung dịch A chứa K+, NH4+, CO32- và ion âm An-
Theo định luật bảo toàn điện tích: 0,15+ 0,25=0,15.2+ n.nAn-
→ n.nAn-= 0,1 mol → Anion còn lại trong dung dịch A là Cl-
→Dung dịch A chứa K+, NH4+, CO32- và Cl-
→mchất rắn khan= 0,15.39 + 0,25.18+ 0,15.60 + 0,1.35,5= 22,9 gam
Dung dịch B chứa H+, Mg2+, SO42- và NO3-
Chú ý khi cô cạn thì axit HNO3 (0,2 mol) sẽ bay hơi cùng nước
→mchất rắn khan= mMg2++ mSO4(2-)+ mNO3- dư
= 0,1.24+ 96.0,075+ 0,05.62=12,7 gam

Câu 1:
Theo ĐLBT ĐT, có: x + 2y = 0,1.2 + 0,2.3 (1)
Theo ĐLBT KL, có: 35,5x + 96y = 44,4 - 0,1.56 - 0,2.27 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,4\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
Câu 2:
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 24y = 5,1 (1)
Có: \(n_{N_2}=0,05\left(mol\right)\)
Theo ĐLBT e, có: 3x + 2y = 0,05.10 (2)
Từ (1) và (2) \(\Rightarrow x=y=0,1\left(mol\right)\)
BTNT Al và Mg, có: \(n_{Al\left(NO_3\right)_3}=n_{Mg\left(NO_3\right)_2}=0,1\left(mol\right)\)
⇒ m muối = 0,1.213 + 0,1.148 = 36,1 (g)
Câu 3:
Có: \(n_{H^+}=0,2.0,01+0,2.0,02.2=0,01\left(mol\right)\)
\(n_{OH^-}=0,3.0,03=0,009\left(mol\right)\)
PT: \(H^++OH^-\rightarrow H_2O\)
__0,01___0,009 (mol)
⇒ H+ dư và nH+ (dư) = 0,001 (mol)
\(\Rightarrow\left[H^+\right]=\dfrac{0,001}{0,2+0,3}=0,002\left(M\right)\)
\(\Rightarrow pH=-log0,002\approx2,7\)
Bạn tham khảo nhé!

Đáp án B
Loại ngay A và D do H+ và CO32- không tồn tại trong cùng 1 dung dịch
Xét B: nK+ + nNH4+ = 0,15 + 0,25 = 0,4 mol; nCl- + 2nCO32- = 0,1 + 2.0,15 = 0,4 mol
=> thỏa mãn định luật bảo toàn điện tích
Xét C: nK+ + 2nMg2+ = 0,15 + 2.0,1 = 0,35 mol; nCl- + 2nSO42- = 0,1 + 2.0,075 = 0,25 mol
=> không thỏa mãn định luật bảo toàn điện tích

Vì có Mg2+ nên dung dịch không có OH- → Loại B và C
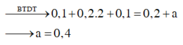
Đáp án A

Đáp án B
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn được thỏa mãn. Ở đây chỉ có đáp án B thỏa mãn.



Đáp án A