Một dung dịch chứa các ion: 0,01 mol ; 0,02 mol ; 0,04 mol ; 0,065 mol ; 0,015 mol Cl- và 0,02 mol . Cần dùng bao nhiêu mol để làm mất hoàn toàn tính cứng ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Theo định luật bảo toàn điện tích có:

Nên tổng khối lượng kết tủa thu được lớn nhất gồm 0,02 mol Mg(OH)2, 0,01 mol Al(OH)3 và 0,02 mol BaSO4
Đáp án B

Giải thích:
BTĐT: 2nMg2++2nCa2+ = nCl- + 2nSO42- + nHCO3- - nNa+
=> 2nMg2+ + 2nCa2+ = 0,01 + 2.0,02 + 0,04 – 0,05 = 0,04 mol
Ta thấy 2(nMg2+ + nCa2+) = nHCO3- => Khi đun nóng mẫu nước trên bị mất tính cứng
Vậy mẫu nước trên là mẫu nước cứng tạm thời
Chú ý:
Nếu mẫu nước đun lên vẫn còn tính cứng thì là nước cứng toàn phần.
Đáp án B

Đáp án B
Để dung dịch tồn tại thì các ion không phản ứng với nhau và định luật bảo toàn được thỏa mãn. Ở đây chỉ có đáp án B thỏa mãn.

Đáp án D
Dể ion Yn- tồn tại được trong dung dịch X thì Yn- không phản ứng với 3 ion còn lại => loại đáp án A và C.
Dung dịch X trung hòa điện tích nên: nK++2nBa2+=nHCO3-+a.n
0,01.1+0,02.2=0,02.1+n.a=>n.a=0,03. Với n=1 thì a=0,03.

Đáp án A
TH1: Ion X có điện tích= -1 ⇒ nX = 0,01 + 0,02×2 – 0,02 = 0,03
⇒ chọn A hoặc D
Loại D vì OH- và HCO3- không cùng tồn tại trong cùng 1 dung dịch
Đáp án A.
TH2: Ion X có điện tích = -2 ⇒ nX = (0,01 + 0,02×2 – 0,02): 2 = 0,015 ( Không thỏa mãn đáp án)

Tổng ion dương là 0,04 mol và tổng ion âm là 0,02 + a => a = 0,02
=> Đáp án B

Đáp án A
Để dung dịch X tồn tại thì Y là NO3- hoặc Cl-
Ta thấy có đáp án A thỏa mãn định luật bảo toàn điện tích:
0,01.1 + 0,02.2 = 0,02.1 + 0,03.1
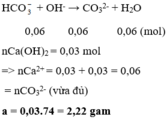
Đáp án cần chọn là: C