Hỗn hợp X chứa 0,2 mol Al; 0,04 mol FeO; 0,05 mol Fe2O3, 0,08 mol CuO và 0,06 mol Fe3O4. Người ta cho X vào ống sứ (không có không khí) rồi nung nóng một thời gian thu được hỗn hợp Y (có chứa 3,84 gam Cu). Tách toàn bộ lượng Cu có trong Y ra ta được hỗn hợp rắn Z. Cho Z tác dụng với lượng vừa đủ HCl thấy thoát ra 3,36 lít khí H2 (đktc) và dung dịch T. Cho AgNO3 dư vào dung dịch T thu được m gam hỗn hợp kết tủa. Giá trị của m là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Khối lượng muối = khối lượng kim loại + khối lượng SO4
220,4 = 57,2 + 96a ---> a = 1,7 mol.
Số mol SO4 trong muối = 1/2 số mol e cho ---> n(e cho) = 3,4 mol.
Bảo toàn e: 3,4 = 3.0,2 + 8.0,2 + 2x ---> x = 0,6 mol.

Câu 1:
Theo ĐLBT ĐT, có: x + 2y = 0,1.2 + 0,2.3 (1)
Theo ĐLBT KL, có: 35,5x + 96y = 44,4 - 0,1.56 - 0,2.27 (2)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}x=0,4\left(mol\right)\\y=0,2\left(mol\right)\end{matrix}\right.\)
Câu 2:
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\)
⇒ 27x + 24y = 5,1 (1)
Có: \(n_{N_2}=0,05\left(mol\right)\)
Theo ĐLBT e, có: 3x + 2y = 0,05.10 (2)
Từ (1) và (2) \(\Rightarrow x=y=0,1\left(mol\right)\)
BTNT Al và Mg, có: \(n_{Al\left(NO_3\right)_3}=n_{Mg\left(NO_3\right)_2}=0,1\left(mol\right)\)
⇒ m muối = 0,1.213 + 0,1.148 = 36,1 (g)
Câu 3:
Có: \(n_{H^+}=0,2.0,01+0,2.0,02.2=0,01\left(mol\right)\)
\(n_{OH^-}=0,3.0,03=0,009\left(mol\right)\)
PT: \(H^++OH^-\rightarrow H_2O\)
__0,01___0,009 (mol)
⇒ H+ dư và nH+ (dư) = 0,001 (mol)
\(\Rightarrow\left[H^+\right]=\dfrac{0,001}{0,2+0,3}=0,002\left(M\right)\)
\(\Rightarrow pH=-log0,002\approx2,7\)
Bạn tham khảo nhé!

Trong \(20,4g\) hỗn hợp có: \(\left\{{}\begin{matrix}n_{Zn}=a\left(mol\right)\\n_{Fe}=b\left(mol\right)\\n_{Al}=c\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow65a+56b+27c=20,4\left(1\right)\)
\(n_{H_2}=\dfrac{10,08}{22,4}=0,45mol\)
\(BTe:2n_{Zn}+2n_{Fe}+3n_{Al}=2n_{H_2}\)
\(\Rightarrow2a+2b+3c=2\cdot0,45\left(2\right)\)
Trong \(0,2mol\) hhX có \(\left\{{}\begin{matrix}Zn:ka\left(mol\right)\\Fe:kb\left(mol\right)\\Al:kc\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow ka+kb+kc=0,2\)
\(n_{Cl_2}=\dfrac{6,16}{22,4}=0,275mol\)
\(BTe:2n_{Zn}+3n_{Fe}+3n_{Al}=2n_{Cl_2}\)
\(\Rightarrow2ka+3kb+3kc=2\cdot0,275\)
Xét thương:
\(\dfrac{ka+kb+kc}{2ka+3kb+3kc}=\dfrac{0,2}{2\cdot0,275}\Rightarrow\dfrac{a+b+c}{2a+3b+3c}=\dfrac{4}{11}\)
\(\Rightarrow3a-b-c=0\left(3\right)\)
Từ (1), (2), (3)\(\Rightarrow\left\{{}\begin{matrix}a=0,1mol\\b=0,2mol\\c=0,1mol\end{matrix}\right.\Rightarrow\left\{{}\begin{matrix}m_{Zn}=6,5g\\m_{Fe}=11,2g\\m_{Al}=2,7g\end{matrix}\right.\)

\(Zn+2HCl\rightarrow ZnCl_2+H_2\\ 2Al+6HCl\rightarrow2AlCl_3+3H_2\\ n_{HCl\left(p.ứ\right)}=0,3.2+0,2.3=1,2\left(mol\right)< 1,5\left(mol\right)\)
Vậy phản ứng xảy ra không hoàn toàn, dư 0,3mol HCl


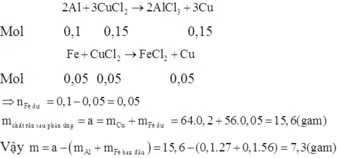
Chọn đáp án B.