Cho 200 ml dd có chứa [NO3-] = 0,15M. Tính khối lượng của Fe(NO3)3có trong dd đó
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án B
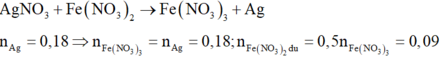
Gọi số mol Al và Mg tối đa mà dung dịch X có thể phản ứng được là x và 3x
Nên 3x + 2.3x = 0,09.2 + 0,18.3(ne cho =ne nhận)
Suy ra x = 0,08 => mAl + mMg = 7,92(g)

Đáp án D.
![]()
Sau khi pư kết thúc thu đc dd A với màu xanh đã nhạt 1 phần à Fe đã phản ứng hết với AgNO3 và phản ứng với một phần Cu(NO3)2.
Gọi số mol Cu(NO3)2 phản ứng là x mol.
Fe + 2AgNO3 à Fe(NO3)2 + 2Ag
0,06ß 0,12 à 0,12
Fe + Cu(NO3)2 à Fe(NO3)2 + Cu
x ß x à x
Vậy mtăng = 0,12.108 + x.64 – 0,06.56 – x.56 = 10,4 ó x = 0,1 mol
Vậy khối lượng đinh sắt ban đầu là: mFe = 0,1.56 + 0,06.56 = 8,96 gam.

\(n_{Cu}=\dfrac{10,24}{64}=0,16\left(mol\right)\)
\(n_{Fe\left(NO_3\right)_3}=0,4.0,5=0,2\left(mol\right)\)
PT: \(Cu+2Fe\left(NO_3\right)_3\rightarrow2Fe\left(NO_3\right)_2+Cu\left(NO_3\right)_2\)
Xét tỉ lệ: \(\dfrac{0,16}{1}>\dfrac{0,2}{2}\), ta được Cu dư.
Theo PT: \(n_{Cu\left(NO_3\right)_2}=\dfrac{1}{2}n_{Fe\left(NO_3\right)_3}=0,1\left(mol\right)\)
\(\Rightarrow m_{Cu\left(NO_3\right)_2}=0,1.188=18,8\left(g\right)\)
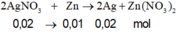
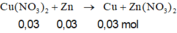
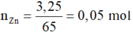
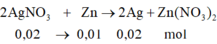
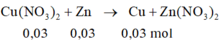
n\(NO_3^-\)=\(\dfrac{200}{1000}\cdot0,15=0,03\)
\(\Leftrightarrow\)3n\(Fe\left(NO_3\right)_3\)=n\(NO_3^-\)=0,03
\(\Rightarrow\)m\(Fe\left(NO_3\right)_3\)=0,03*(56+14*3+9*16)=7,26