Cho hỗn hợp X gồm :0,25 mol Mg;0,3 mol Cu;0,2 mol Fe vào dung dịch chứa 1,5 mol AgNO3.tính m kết tủa thu đc sp ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Gọi số mol Al, Mg lần lượt là: x, y (mol)
=> 27x + 24y = 9 (*)
Ta có: \(\overset{0}{Al}\rightarrow\overset{+3}{Al}+3e\)
x \(\rightarrow\) 3x (mol)
\(\overset{0}{Mg}\rightarrow\overset{+2}{Mg}+2e\)
y \(\rightarrow\) 2y (mol)
\(\overset{0}{O_2}+4e\rightarrow\overset{-2}{2O}\)
0,1\(\rightarrow\) 0,4 (mol)
\(\overset{0}{Cl_2}+2e\rightarrow\overset{-1}{2Cl}\)
0,25 \(\rightarrow\) 0,5 (mol)
Theo ĐLBT e, ta có: 3x +2y = 0,9 (**)
Từ (*) và (**), có: \(\left\{{}\begin{matrix}x=0,2\left(mol\right)\\y=0,15\left(mol\right)\end{matrix}\right.\)
=> mAl = 5,4 (g) => %mAl = 60%
=> %mMg = 40 %

Chọn C.
Khi nung hỗn hợp X thì :
![]()
Xét quá trình Y tác dụng với 1,3 mol HCl thì :
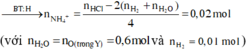
Hỗn hợp muối gồm Cu2+ (0,25 mol), Cl- (1,3 mol), NH4+ (0,02 mol) và Mg2+


Đáp án C
- Khi nung nóng hỗn hợp X thì: ![]()
- Xét quá trình Y tác dụng với 1,3 mol HCl thì: 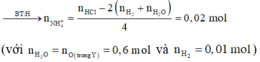
- Hỗn hợp muối gồm 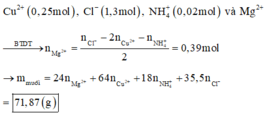

Đáp án A
Đặt nN2 = x; nH2 = y ⇒ nT = x + y = 0,05 mol
mT = 28x + 2y = 0,05 × 11,4 × 2 ||⇒ giải hệ có: x = 0,04 mol; y = 0,01 mol.
● Bảo toàn nguyên tố Oxi: nH2O = nO/Y = 0,25 × 6 – 0,45 × 2 = 0,6 mol.
Bảo toàn nguyên tố Hidro: nNH4+ = (1,3 – 0,6 × 2 – 0,01 × 2) ÷ 4 = 0,02 mol.
Bảo toàn điện tích: nMg2+ = (1,3 – 0,02 – 0,25 × 2) ÷ 2 = 0,39 mol.
► m = 0,39 × 24 + 0,25 × 64 + 0,02 × 18 + 1,3 × 35,5 = 71,87(g)

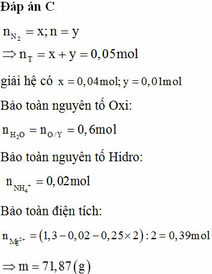




PTHH :
\(Mg+2AgNO3->Mg\left(NO3\right)2+2Ag\downarrow\)
0,25mol...0,5mol....................................0,5mol
Ta có : nMg = \(\dfrac{0,25}{1}mol< nAgNO3=\dfrac{1,5}{2}mol\)
=> nAgNO3 còn dư ( tính theo nMg)
=> nAgNO3(dư) = 1,5-0,5=1(mol)
\(Fe+2AgNO3->Fe\left(NO3\right)2+2Ag\downarrow\)
0,2mol....0,4mol..................................0,4mol
Ta có : nFe = \(\dfrac{0,2}{1}mol< nAgNO3=\dfrac{1}{2}mol\)
=> nAgNO3 còn dư (tính theo nFe)
=> nAgNO3(dư) = 1-0,4=0,6(mol)
\(Cu+2AgNO3->Cu\left(NO3\right)2+2Ag\downarrow\)
Ta có : nCu =\(\dfrac{0,3}{1}mol=nAgNO3=\dfrac{0,6}{2}mol\)
=> nAgNO3 pư hết với Cu
=> mKt=mAg = (0,5+0,4+0,6).108=162(g)
Vậy...