Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

ngoại trừ He, các nguyên tố khí hiếm còn lại đều có số e lớp ngoài cùng là 8

(1) vô cùng nhỏ
(2) trung hòa về điện
(3) hạt nhân
(4) điện tích dương
(5) vỏ nguyên tử
(6) các electron
(7) điện tích âm
(8) chuyển động
(9) sắp xếp

Câu 1:
Nitơ: \(N_2\)
Oxi: \(O_2\)
Hidro: \(H_2\)
Lưu huỳnh: S

a)
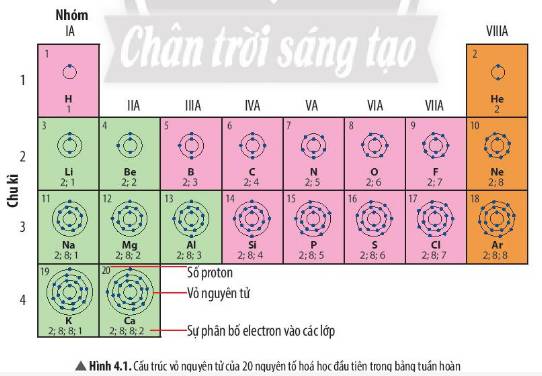
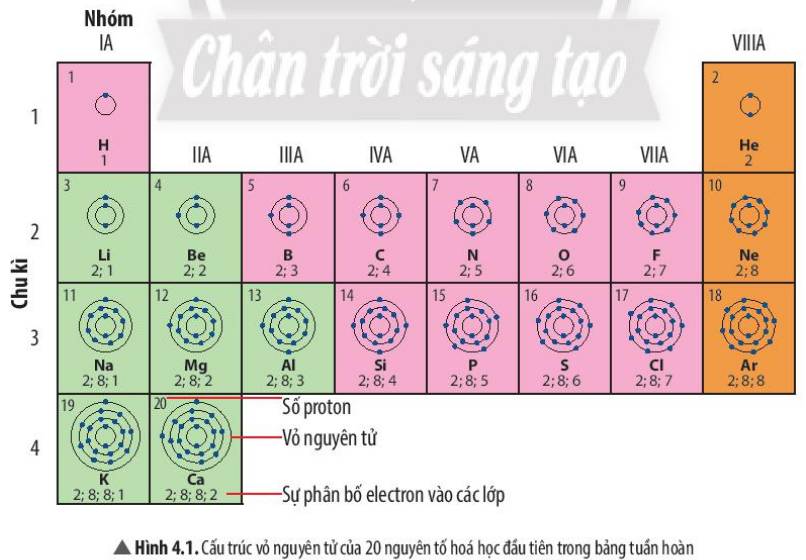
1 lớp:H,He
2 lớp:Li, Be, B, C, N, O, F
3 lớp:Na, Mg, Al, Si, P, S, Cl, Ar
4 lớp:K,Ca
b)
1 e ngoài cùng:H, Li, Na, K
2 e ngoài cùng:Be, Mg, Ca
3 e ngoài cùng:B, Al

1. Nguyên tử nguyên tố H , nguyên tử nguyên tố He có 1 lớp e
Nguyên tử nguyên tố Li, Be, C, N có 2 lớp e.
2. STT chu kì của nguyên tử nguyên tố H, He (1) < STT chu kì của nguyên tử nguyên tố Li, Be, C, N (2)

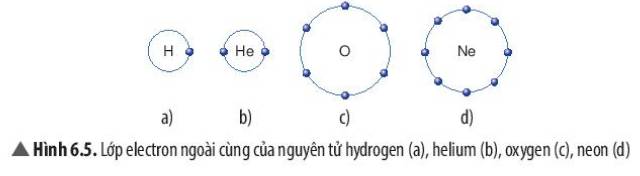
- Xét phân tử hydrogen: mỗi nguyên tử hydrogen có 2 electron lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Helium
- Xét phân tử Oxygen: mỗi nguyên tử Oxygen có 8 electron ở lớp ngoài cùng
=> Giống cấu hình electron của nguyên tử khí hiếm Neon

1:
Nguyên tử Li, Na có cũng số electron ở lớp ngoài cùng
Nguyên tử F, Cl có cũng số electron ở lớp ngoài cùng
2: Số electron lớp ngoài cùng của nguyên tử các nguyên tố chính là số thứ tự nhóm của các nguyên tố

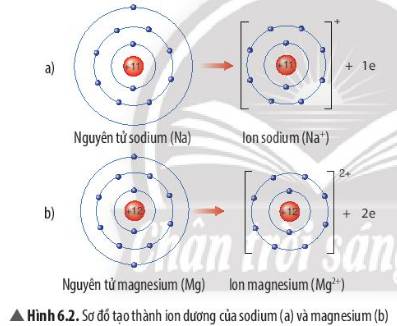
- Sự tạo thành ion sodium: Nguyên tử sodium (Na) cho đi 1 electron lớp ngoài cùng để tạo thành ion dương Na+
- Sự tạo thành ion magnesium: Nguyên tử magnesium (Mg) cho đi 2 electron lớp ngoài cùng để tạo thành ion dương Mg2+
=> Sau khi nhường electron, ion sodium và ion magnesium đều có 2 lớp electron và có 8 electron ở lớp ngoài cùng
=> Sự phân bố electron của 2 ion này giống sự phân bố electron của nguyên tử khí hiếm Neon (Ne)


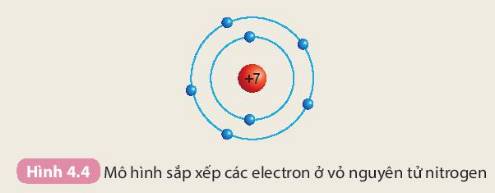
Hiểu về nguyên tử là một trong những khái niệm quan trọng trong hóa học, và nó có thể hơi khó hiểu nếu không làm quen với các khái niệm cơ bản. Mình sẽ giải thích một cách đơn giản để bạn dễ hiểu hơn nhé!
Nguyên tử là gì?
Nguyên tử là đơn vị nhỏ nhất của chất mà vẫn giữ được tính chất của chất đó. Mỗi nguyên tử có một hạt nhân ở trung tâm và các electron xung quanh. Bạn có thể tưởng tượng nguyên tử giống như một hành tinh nhỏ, trong đó hạt nhân giống như Mặt Trời và các electron là các hành tinh quay xung quanh.
Cấu tạo của nguyên tử
Lớp electron trong nguyên tử
Nguyên tử không phải là một khối vật chất đặc, mà các electron quay xung quanh hạt nhân trong các lớp (hay còn gọi là quỹ đạo electron). Các lớp này được ký hiệu là Lớp 1, Lớp 2, Lớp 3, v.v. Mỗi lớp có thể chứa một số lượng electron nhất định:
Các lớp này giống như các tầng trong một tòa nhà, mỗi lớp càng cao thì càng có thể chứa nhiều electron.
Vì sao các lớp lại quan trọng?
Ví dụ minh họa
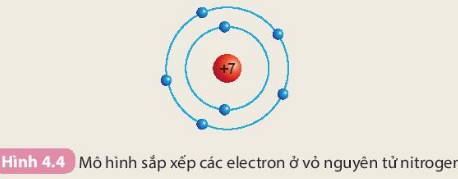
Hãy lấy nguyên tử carbon (C) làm ví dụ:
Vậy, carbon có 4 electron ở lớp ngoài cùng. Điều này giải thích tại sao carbon có khả năng kết hợp với nhiều nguyên tử khác để tạo ra các hợp chất như CO2, CH4, v.v.
Tóm tắt
Hi vọng là bạn đã hiểu phần cơ bản về nguyên tử và các lớp electron! Nếu có câu hỏi gì thêm hoặc cần giải thích kỹ hơn, cứ hỏi mình nhé! 😊