Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

- Bàn chân của tắc kè có rất nhiều sợi lông cực nhỏ, được gọi là sợi stetae có kích thước cỡ micromet. Ở đầu mỗi sợi lông lại phân nhánh thành rất nhiều sợi lông nhỏ dơn được gọi là spatulae với kích cỡ nanomet.
- Các sợi spatulae cho phép tắc kè bám được trên trường hay mặt phẳng nhờ tương tác tĩnh điện “hai điện tích trái dấu hút nhau”. Mỗi phân tử trong cơ thể sống hoặc một vật nào đó thường cân bằng về điện tích. Nhưng một mặt có xu hướng mang điện tích dương và mặt còn lại mang điện tích âm. Khi tắc kè leo tường, các sợi spatulae siêu nhỏ có thể quay mặt mang điện tích âm của chúng về phía mặt mang điện tích dương của phân tử trên bề mặt tường (và ngược lại), tạo ra lực hút giữa các phân tử được gọi là lực liên kết Van der Waals.

Các hiện tượng có xuất hiện của liên kết hydrogen, tương tác van der Waals trong thực tiễn:
- Liên kết hydrogen: có trong DNA để tạo thành các chuỗi kép, hình thành cấu trúc chuỗi cấp trong các protein…
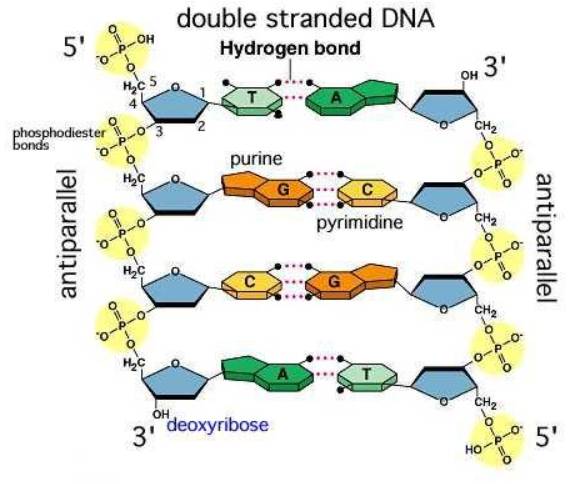
Liên kết hydrogen trong nước giúp duy trì sự ổn định chất lỏng trong một phạm vi diện rộng, làm cho băng đá nhẹ hơn nước lỏng bởi vậy băng nổi trên mặt nước, nước có thể bay hơi làm cho hệ sinh thái trên Trái Đất tuần hoàn tự nhiên.
- Lực tương tác van der Waals: sự bám hút của hạt bụi trên bề măt; tắc kè, thạch sùng có thể bám chắc trên các bề mặt trơn nhẵn; khả năng kết dính của băng dính; sự hấp phụ chất độc và phân tử màu trong nước bởi than hoạt tính…
So sánh được tính chất vật lí giữa các phân tử dựa vào liên kết hydrogen và tương tác van der Waals.

Để so sánh được tính chất vật lí giữa các phân tử, chúng ta cần nắm được những ý sau:
- Liên kết hydrogen được hình thành giữa nguyên tử H (đã liên kết với một nguyên tử có độ âm điện lớn) với một nguyên tử khác (có độ âm điện lớn) còn cặp electron hóa trị chưa tham gia liên kết.
⇒ Liên kết hydrogen làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của nước.
- Tương tác van der Waals là tương tác tĩnh điện lưỡng cực – lưỡng cực được hình thành giữa các phân tử hay nguyên tử.
⇒ Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất.

Lực Van der Waals là một loại tương tác giữa các phần tử có tiếp xúc với nhau, được đặt tên của nhà vật lý người Hà Lan Johannes Diderik van der Waals, mô tả một loại tương tác phụ thuộc vào khoảng cách giữa các phần tử, công bố đầu tiên vào năm 1873. Các phần tử tham gia vào lực này thường là phân tử.
Thực chất, lực Van der Waals là lực tĩnh điện, thường xuất hiện giữa các phân tử chất khí, khí hóa lỏng hoặc hóa rắn, và trong hầu hết các chất lỏng và chất rắn hữu cơ.
- Tương tác van der Waals làm tăng nhiệt độ nóng chảy và nhiệt độ sôi của các chất. Khi khối lượng phân tử tăng, kích thước phân tử tăng thì tương tác van der Waals tăng.
-Tương tác van der Waals làm tăng nhiệt độ sôi và nhiệt độ nóng chảy. ⟹ Khí hiếm có nhiệt độ nóng chảy thấp nhất là He và cao nhất là Xe.

Nhiệt độ sôi của hydrogen bromide cao hơn nhiệt độ sôi của hydrogen chloride được giải thích như sau:
+ Khối lượng phân tử HBr (81) cao hơn khối lượng phân tử HCl (36,5)
+ Br có bán kính nguyên tử lớn, có nhiều electron hơn Cl => Tăng khả năng lưỡng cực HX => Làm tăng tương tác van der Waals giữa các phân tử

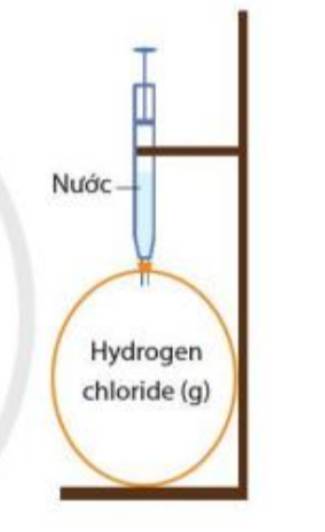
Khí hydrogen chloride tan nhiều trong nước tạo thành dung dịch hydrochloric acid
=> Khi bơm nước vào, khí hydrogen chloride bị hòa tan hết
=> Quả bóng bị xẹp vào

a)
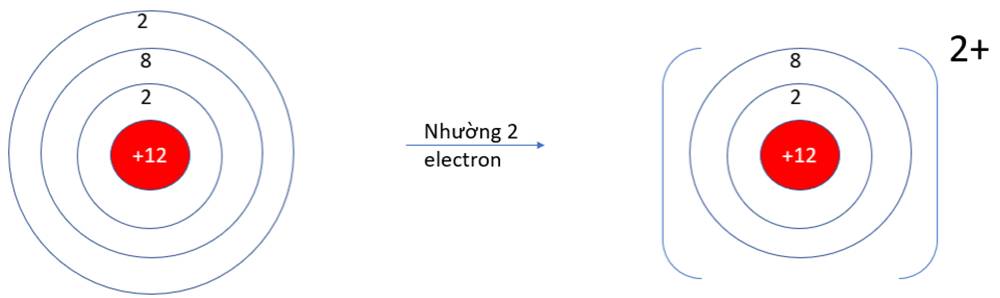
- Ở dạng nguyên tử, Na và Mg đều có 3 lớp electron. Ở dạng ion Na+, Mg2+ chỉ có 2 lớp electron
=> Bán kính nguyên tử Na, Mg lớn hơn bán kính các ion kim loại tương ứng
b, Mỗi nguyên tử Na đã nhường 1 electron, nguyên tử O nhận 2 electron từ nguyên tử Na để hình thành hợp chất ion Na2O.
2Na+ + O2- → Na2O
Vì Na2O là hợp chất ion nên ở điều kiện thường Na2O tồn tại ở thể rắn.
Nguyên tử Mg nhường 2 electron, nguyên tử O nhận 2 electron từ nguyên tử Mg để hình thành hợp chất ion MgO.
Mg2+ + O2- → MgO
Vì MgO là hợp chất ion nên ở điều kiện thường MgO tồn tại ở thể rắn.
c, Tá có:
+ Bán kính ion Na+ < bán kính ion Mg2+.
+ Điện tích ion Mg2+ < điện tích ion Na+.
Vậy nhiệt độ nóng chảy của MgO (2852oC) cao hơn rất nhiều so với Na2O (1132oC) do năng lượng phân li tỉ lệ thuận với điện tích ion và tỉ lệ nghịch với bán kính ion.

- Khi potassium bromide phản ứng với sulfuric acid đặc, đun nóng. Ta có phương trình:
2NaBr(s) + 3H2SO4(l) \(\xrightarrow{{{t^o}}}\) 2NaHSO4(s) + Br2(g) + SO2(g) + 2H2O(g)
=> Sản phẩm tạo thành không có HBr
=> Không thể điều chế hydrogen bromide từ phản ứng giữa potassium bromide với sulfuric acid đặc

Mặc dù có độ âm điện tương đương nhau nhưng trong phân tử Cl2Cl2 chỉ có liên kết đơn (liên kết σσ) trong khi đó nitơ tồn tại ở dạng phân tử hai nguyên tử với liên kết ba (11 liên kết σσ và hai liên kết )N≡N. Năng lượng cần để phá vỡ liên kết ba trong phân tử nitơ lớn hơn nhiều so với năng lượng cần để phá vỡ một liên kết đơn trong phân tử clo. Do vậy ở điều kiện thường nitơ có khả năng phản ứng kém hơn clo.
Mặc dù có độ âm điện tương đương nhau nhưng trong phân tử Cl2Cl2 chỉ có liên kết đơn (liên kết σσ) trong khi đó nitơ tồn tại ở dạng phân tử hai nguyên tử với liên kết ba (11 liên kết σσ và hai liên kết π)N≡Nπ)N≡N. Năng lượng cần để phá vỡ liên kết ba trong phân tử nitơ lớn hơn nhiều so với năng lượng cần để phá vỡ một liên kết đơn trong phân tử clo. Do vậy ở điều kiện thường nitơ có khả năng phản ứng

Con tắc kè có thể di chuyển trên mặt kính trơn nhẵn, thẳng đứng vì có sự bám hút (tương tác van der Waals) giữa bàn chân con tắc kè và mặt kính.
Tắc kè và thằn lằn có khả năng bám lên mặt kính trơn bóng nhờ vào cấu trúc đặc biệt trên bề mặt bàn chân của chúng. Cụ thể, bàn chân của tắc kè và thằn lằn được phủ bởi hàng triệu sợi lông cực nhỏ gọi là setae. Mỗi sợi lông này lại chia thành hàng trăm sợi lông nhỏ hơn gọi là spatulae. Các spatulae này tương tác với bề mặt kính thông qua lực Van der Waals, một loại lực hút yếu giữa các phân tử. Mặc dù lực này rất nhỏ khi tính trên mỗi sợi lông, nhưng khi hàng triệu sợi lông cùng tương tác với bề mặt, chúng tạo ra một lực tổng cộng đủ mạnh để giữ cho tắc kè và thằn lằn bám chặt vào mặt kính. Khả năng này cho phép tắc kè và thằn lằn di chuyển linh hoạt trên các bề mặt trơn bóng mà không bị trượt ngã.