Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Tính chất chung của kim loại SVIP
I. TÍNH CHẤT VẬT LÍ CỦA KIM LOẠI
Kim loại có tính dẻo, dẫn điện, dẫn nhiệt và ánh kim.
1. Tính dẻo
Kim loại dễ biến dạng khi rèn, kéo sợi hoặc dát mỏng nhờ tính dẻo.
Ví dụ: Giấy bọc thực phẩm được sản xuất từ nhôm.

2. Tính dẫn diện
Tất cả kim loại đều dẫn điện, nhưng khả năng dẫn điện khác nhau. Dãy dẫn điện của kim loại theo thứ tự giảm dần là Ag, Cu, Au, Al,...
Ví dụ: Khi chạm hai đầu dây dẫn vào mẩu kim loại thì đèn sáng.

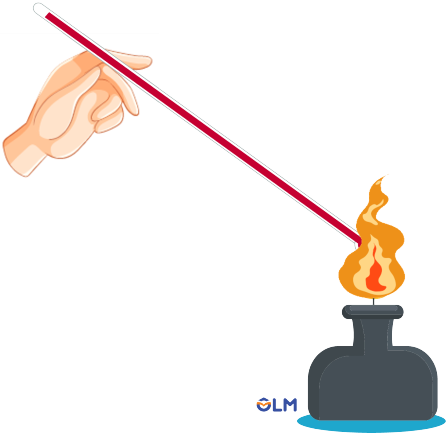
3. Tính dẫn nhiệt
Kim loại có khả năng dẫn nhiệt. Các kim loại dẫn điện tốt thường dẫn nhiệt tốt.
Ví dụ: Hơ nóng một đầu dây nhôm trên đèn cồn. Mặc dù tay không tiếp xúc với ngọn lửa nhưng vẫn cảm thấy nóng.
4. Tính ánh kim
Trên bề mặt của kim loại có vẻ sáng lấp lánh gọi là ánh kim.
Ví dụ: Vàng, bạc thường được sử dụng làm trang sức.

5. Một số tính chất vật lí khác của kim loại
- Khối lượng riêng cho biết mức độ nặng hay nhẹ của các kim loại.
- Nhiệt độ nóng chảy là điểm mà kim loại chuyển từ thể rắn sang thể lỏng.
- Các kim loại có độ cứng khác nhau.
Câu hỏi:
@202215965879@
II. TÍNH CHẤT HÓA HỌC
Kim loại phản ứng được với phi kim, nước, dung dịch acid và dung dịch muối.
1. Phản ứng của kim loại với phi kim
➤ Tác dụng với oxygen
- Các kim loại như Cu, Fe, Zn, Al, Mg, Ca,... phản ứng với oxygen tạo thành oxide kim loại.
- Một số kim loại như Au, Ag, Pt, Hg,... không phản ứng với oxygen.
- Một số kim loại như Al, Zn, Cr,... phản ứng với oxygen tạo thành lớp màng oxide mỏng, bền, bảo vệ bề mặt không cho kim loại tiếp tục phản ứng.
Ví dụ: Đốt cháy dây đồng trong khí oxygen.
\(2Cu+O_2\rarr2CuO\)
➤ Tác dụng với phi kim khác
Kim loại có thể tác dụng với nhiều phi kim khác tạo thành muối.
Ví dụ: Sắt tác dụng với khí chlorine.

Câu hỏi:
@202229766576@
2. Phản ứng của kim loại với dung dịch acid
- Kim loại phản ứng với dung dịch hydrochloric acid tạo thành muối chloride và khí hydrogen.
- Một số kim loại Ag, Cu, Au,... không phản ứng với dung dịch hydrochloric acid.
Ví dụ:
\(Mg+2HCl\rarr MgCl_2+H_2\)
Câu hỏi:
@202756833431@
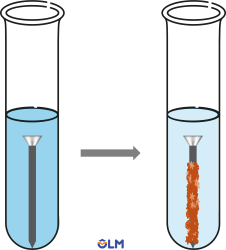
3. Phản ứng của kim loại với dung dịch muối
- Các kim loại (trừ K, Na, Ca,...) có thể phản ứng với dung dịch muối để tạo muối mới và kim loại mới.
Ví dụ: Sắt phản ứng với dung dịch CuSO4.
Câu hỏi:
@202756581449@
4. Phản ứng với nước
- Các kim loại như Na, K, Ca,... phản ứng mạnh với nước tạo thành hydroxide, giải phóng khí hydrogen và tỏa nhiều nhiệt.
Ví dụ:
\(2K+2H_2O\rarr2KOH+H_2\)
- Một số kim loại như Zn, Fe,... tác dụng với hơi nước nóng tạo thành oxide và khí hydrogen.
Ví dụ:
\(Fe+H_2O\overset{t^{o}}{\rarr}FeO+H_2\)
- Một số kim loại như Ag, Cu, Au,... không phản ứng với nước do hoạt động hóa học yếu.
III. SỰ KHÁC BIỆT VỀ TÍNH CHẤT CỦA MỘT SỐ KIM LOẠI
Nhôm, sắt và vàng có nhiều tính chất riêng biệt nên được ứng dụng rộng rãi trong đời sống và công nghiệp.
Kim loại | Nhôm | Sắt | Vàng |
|---|---|---|---|
Màu sắc | Trắng bạc | Trắng xám | Vàng |
Tính chất vật lí | Mềm, nhẹ, dẫn điện và nhiệt tốt | Cứng, dẻo, có tính nhiễm từ | Dẻo, dẫn điện và nhiệt rất tốt |
Tính chất hóa học | - Tác dụng với phi kim, dung dịch acid và dung dịch muối. - Bền trong không khí nhờ lớp oxide. | - Tác dụng với phi kim, dung dịch acid, dung dịch muối và hơi nước ở nhiệt độ cao. - Tác dụng với oxygen trong không khí. | - Không tan trong HCl, H2SO4. - Bền trong không khí. |
Ứng dụng | Dây dẫn điện, khung cửa, vách ngăn,... | Gang, thép,... | Đồ trang sức, mạch điện tử,... |
Bạn có thể đăng câu hỏi về bài học này ở đây
