Báo cáo học liệu
Mua học liệu
Mua học liệu:
-
Số dư ví của bạn: 0 coin - 0 Xu
-
Nếu mua học liệu này bạn sẽ bị trừ: 2 coin\Xu
Để nhận Coin\Xu, bạn có thể:

Alkene SVIP
I. KHÁI NIỆM ALKENE
Alkene là hydrocarbon mạch hở có một liên kết đôi C=C, công thức chung là CnH2n (n ≥ 2, n là số nguyên, dương).
Ví dụ: CH2=CH2, CH2=CH-CH3,...
Câu hỏi:
@202831868952@
II. ETHYLENE
1. Công thức cấu tạo và tính chất vật lí
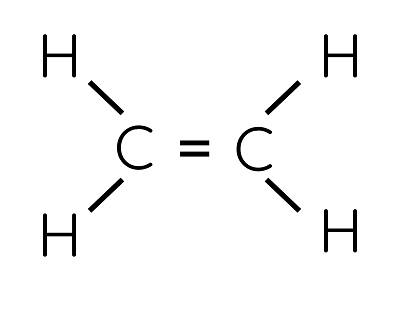
Phân tử ethylene có liên kết đôi C=C, trong đó có một liên kết kém bền, dễ bị phá vỡ trong các phản ứng hóa học.
Ethylene là chất khí nhẹ, không màu, không mùi và hầu như không tan trong nước.
Công thức phân tử của ethylene là C2H4. Công thức cấu tạo của ethylene như sau:
Câu hỏi:
@202831932478@
2. Tính chất hóa học
Ethylene có thể tham gia phản ứng với nước bromine, phản ứng đốt cháy và phản ứng trùng hợp.
➤ Phản ứng làm mất màu dung dịch nước bromine
⚡THÍ NGHIỆM 1
Sục khí ethylene vào ống nghiệm chứa nước Br2.

Ở phản ứng cộng bromine, liên kết kém bền trong liên kết đôi C=C của ethylene bị phá vỡ tạo thành dibromoethane.
\(CH_2=CH_2+Br_2\rarr CH_2Br-CH_2Br\)
Câu hỏi:
@202831933308@
➤ Phản ứng trùng hợp
Ở điều kiện thích hợp, các phân tử ethylene cộng hợp với nhau, liên kết đôi bị phá vỡ tạo thành polymer có khối lượng phân tử lớn.
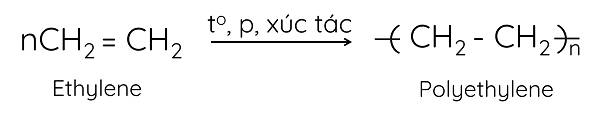
Câu hỏi:
@202831935844@
➤ Phản ứng cháy
⚡THÍ NGHIỆM 2
Đốt cháy khí ethylene ở đầu ống thủy tinh vuốt nhọn.
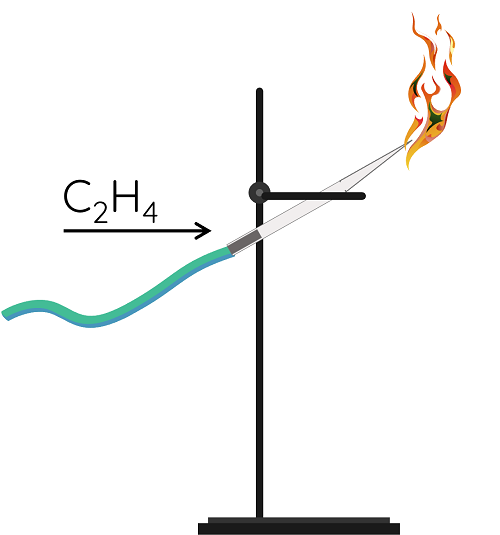
Alkene cháy tạo thành carbon dioxide và hơi nước, phản ứng tỏa nhiều nhiệt.
\(C_2H_4+3O_2\overset{t^{o}}{\rarr}2CO_2+2H_2O\)
3. Ứng dụng
Ethylene là một nguyên liệu quan trọng trong công nghiệp hóa chất và tổng hợp polymer.
- Kích thích hoa quả mau chín.
- Tổng hợp ethylic alcohol, acetic acid.
- Sản xuất polyethylene (PE), poly(vinyl chloride) (PVC).

Túi nylon sản xuất từ PE
Bạn có thể đăng câu hỏi về bài học này ở đây
