Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Dung dịch sulfuric acid đặc được dùng làm khô khí H2, CO2, SO2, O2
Vì: Do sulfuric acid đặc có tính oxi hoá mạnh nên sẽ tác dụng được với những chất có tính khử mạnh như: NH3, CO

1. Tính chất hóa học cơ bản:
+ Của axit mạnh: phản ứng nhanh với kim loại, dung dịch dẫn điện tốt, phản ứng được với muối cacbonat.
+ Của axit yếu: phản ứng chậm với kim loại, dung dịch dẫn điện kém, phản ứng được với muối cacbonat.
2.
PTHH:
\(H_2SO_4+Fe\rightarrow FeSO_4+H_2\\ H_2SO_4+MgO\rightarrow MgSO_4+H_2O\\H_2SO_4+Na_2CO_3\rightarrow Na_2SO_4+H_2O+CO_2\\ H_2SO_4+BaCl_2\rightarrow BaSO_4+2HCl \)

(1) \(4FeS_2+11O_2\underrightarrow{t^o}2Fe_2O_3+8SO_2\)
(2) \(2SO_2+O_2\xrightarrow[_{V_2O_5}]{^{t^o}}2SO_3\)
(3) \(nSO_3+H_2SO_4\rightarrow H_2SO_4.nSO_3\)
(4) \(H_2SO_4.nSO_3+nH_2O\rightarrow\left(n+1\right)H_2SO_4\)
a) 4FeS2 + 11O2 → 2Fe2O3 +8SO2 (1)
Phản ứng (1) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: FeS2
2SO2 + O2 →𝑡𝑜,𝑉2𝑂5 2SO3 (2)
Phản ứng (2) là phản ứng oxi hoá - khử; chất oxi hoá: O2; chất khử: SO2
SO3 + H2O → H2SO4 (3)
Phản ứng (3) không là phản ứng oxi hoá - khử
b) 1 tấn quặng chứa 60% FeS2 (M = 120 g/𝑚𝑜𝑙−1)
Số mol FeS2 trong 1 tấn quặng trên là: 106120.60100= 5000 mol
Sơ đồ phản ứng: FeS2 → 2SO2 → 2SO3 → 2H2SO4
Dựa trên sơ đồ có số mol H2SO4 là 2.5000 = 10 000 mol.
Khối lượng H2SO4 thu được là:
98 × 10 000 = 980 000 gam = 980 kg = 0,98 tấn.
Khối lượng H2SO4 98% thu được là: 0,9898.100=1tấn.
Do hiệu suất cả quá trình là 80% nên khối lượng H2SO4 98% thực tế thu được là:
1.80100=0,8 tấn.
c) Trong FeS2 nguyên tố S có số oxi hóa -1, đề xuất công thức cấu tạo là:

Phương trình hóa học:
\(Ca_3\left(PO_4\right)_2+2H_2SO_{4\left(đặc\right)}\rightarrow Ca\left(H_2PO_4\right)_2+2CaSO_4.\)
\(Ca_3\left(PO_4\right)_2+3H_2SO_{4\left(đặc\right)}\rightarrow2H_3PO_4+3CaSO_4.\)
\(Ca_3\left(PO_4\right)_2+2H_2SO_4\left(đ\right)\rightarrow Ca\left(H_2PO_4\right)_2+2CaSO_4\)
\(Ca_3\left(PO_4\right)_2+3H_2SO_4\left(đ\right)\rightarrow2H_3PO_4+3CaSO_4\)
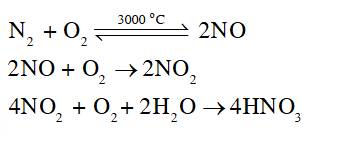


Các phương trình hoá học minh hoạ:
- Tác động của mưa acid đối với calcium carbonate trong núi đá vôi:
2H+ + CaCO3 → Ca2+ + CO2 + H2O.
- Tác động của mưa acid đối với kim loại sắt có trong thép:
2H+ + Fe → Fe2+ + H2.