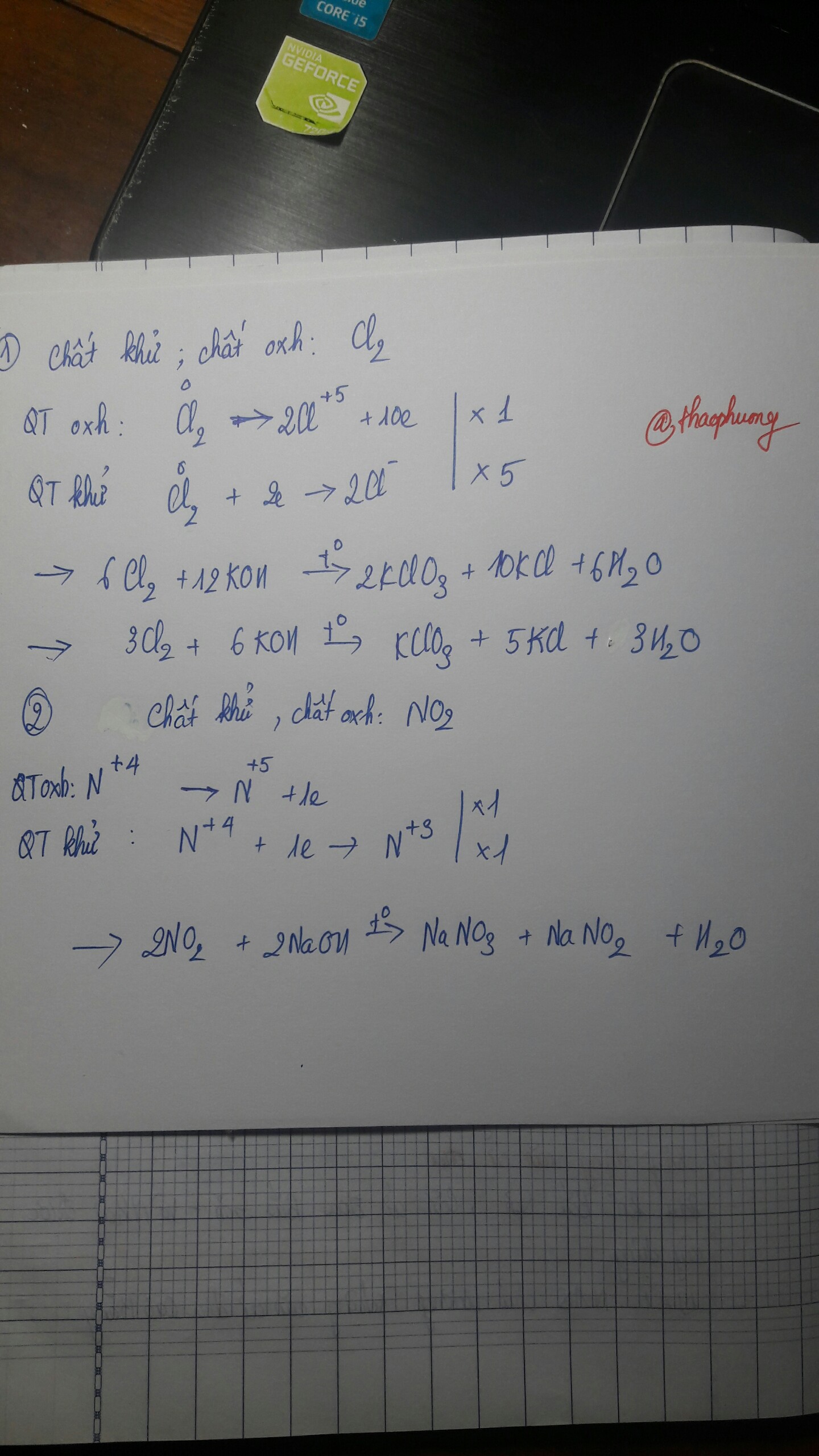Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Đáp án C
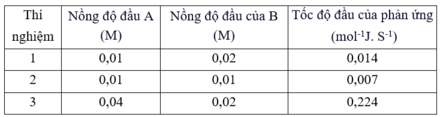
So với TN1, TN2 có nồng độ chất B giảm 2 lần, nồng độ chất A giữ nguyên, làm cho tốc độ phản ứng giảm 2 lần. Kết luận tốc
độ phản ứng tỉ lệ thuận với nồng độ chất B.
So với TN1, TN3 có nồng độ chất A tăng 4 lần, nồng độ chất B giữ nguyên, làm cho tốc độ phản ứng tăng 16 lần. Kết luận tốc
độ phản ứng tỉ lệ thuận với bình phương nồng độ chất A.

1) (5x-2y)Fe + (18x-6y)HNO3 --> (5x-2y)Fe(NO3)3 + 3NxOy + (9x-3y)H2O
Chất khử: Fe
Chất oxh: HNO3
| QT oxh | Fe0 -3e --> Fe+3 | x(5x-2y) |
| QT khử | xN+5 + (5x-2y)--> \(N_x^{+\dfrac{2y}{x}}\) | x3 |
2) 2M + 2nH2SO4 --> M2(SO4)n + nSO2 + 2nH2O
Chất khử: M
Chất oxh: H2SO4
| QT oxh | 2M0 -2ne --> M2+n | x1 |
| QT khử | S+6 + 2e --> S+4 | xn |

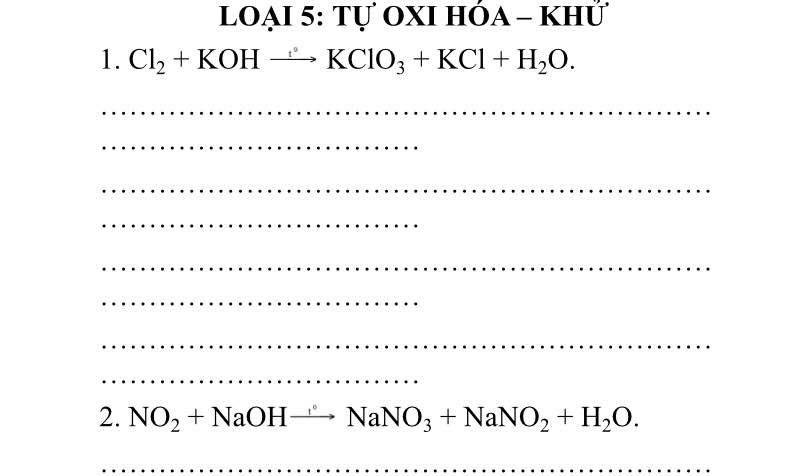
3Cl2 + 6KOH --> KClO3 + 5KCl + 3H2O
Chất oxi hóa: Cl2
Chất khử: Cl2
| QT oxh | Cl0 -5e --> Cl+5 | x1 |
| QT khử | Cl0 + 1e --> Cl-1 | x5 |
2NO2 + 2NaOH --> NaNO3 + NaNO2 + H2O
Chất oxh: NO2
Chất khử: NO2
| QT oxh | N+4 -1e --> N+5 | x1 |
| QT khử | N+4 +1e --> N+3 | x1 |

a) Muối ăn (NaCl) là tinh thể ion, giữa các ion Na+ và Cl- có lực hút tĩnh điện rất mạnh nên muối ăn khó nóng chảy hay có nhiệt độ nóng chảy cao.
b) Các hợp chất ion ở trạng thái nóng chảy hoặc dung dịch sẽ dẫn điện, vì:
- Khi nóng chảy hoặc tan trong nước, các ion bị tách khỏi mạng lưới tinh thể, chuyển động khá tự do và là tác nhân dẫn điện.
- Ở trạng thái rắn, các ion không di chuyển tự do được nên hợp chất ion không dẫn điện.

1. \(2KClO_3\underrightarrow{t^o}2KCl+3O_2\)
Chất khử: KClO3; Chất oxh: KClO3
| QT khử | Cl+5 +6e-->Cl-1 | x2 |
| QT oxh | 2O-2 -4e --> O20 | x3 |
2. 2Mg(NO3)2 --to--> 2MgO + 4NO2 + O2
Chất khử: Mg(NO3)2; Chất oxh: Mg(NO3)2
| QT khử | N+5 +1e --> N+4 | x4 |
| QT oxh | 2O-2 -4e --> O20 | x1 |

20 tấn = 20 000 kg
\(m_{NaCl} = 20 000.90\% = 18000(kg)\\ n_{NaCl} = \dfrac{18000}{58,5}= \dfrac{4000}{13}(kmol)\\ n_{NaCl\ pư} = \dfrac{4000}{13}.65\% = 200(kmol)\\ 2NaCl + 2H_2O \xrightarrow{đpdd} 2NaOH + Cl_2 + H_2\\ n_{Cl_2} = \dfrac{1}{2}n_{NaCl} = 100(kmol)\\ V_{Cl_2} = 100.22,4 = 2240(m^3)\)

1/ Quá trình khử là quá trình nhường electron của một chất.
Ví dụ Trong phản ứng: Fe + 2HCl -> FeCl2 + H2 thì Fe đã bị khử thành Fe (+2)
2/ Quá trình oxy hoá là quá trình nhận electron của một chất.
Ví dụ: cũng trong phản ứng trên, H+ bị oxi hoá thành H2

\(B1.\overset{0}{Mg}+H_2\overset{+6}{S}O_4\rightarrow\overset{2+}{Mg}SO_4+H_2\overset{2-}{S}+H_2O\\ B2+B3.QToxh:Mg\rightarrow Mg^{2+}+2e|\times4\\ QTkhử:S^{+6}+8e\rightarrow S^{2-}|\times1\\ B4.4Mg+5H_2SO_4\rightarrow4MgSO_4+H_2S+4H_2O\)