Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

1) \(n_{H^+}=n_{HCl}+2n_{H2SO4}\)
= 0,0025 + 2.0,0025
= 0,0075(mol)
\(\Rightarrow\left[H^+\right]_{sau.khi.trộn}=\dfrac{0,0075}{0,1+0,05}=0,05M\)
\(\Rightarrow pH=-log\left(0,05\right)\approx1,3\)
Chúc bạn học tốt
2) \(n_{HCl}=0,5.0,04=0,02\left(mol\right)\)
\(n_{NaOH}=0,5.0,06=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,02 0,03
Xét tỉ lệ : \(0,02< 0,03\Rightarrow OH^-dư\)
\(n_{OH^-\left(dư\right)}=0,03-0,02=0,01\left(mol\right)\)
\(\Rightarrow\left[OH^-\right]=\dfrac{0,01}{0,04+0,06}=0,1M\)
\(\Rightarrow pH=14+log\left(0,1\right)=13\)
Chúc bạn học tốt

Pt ion: OH- + H+ → H2O
Ta có: \(\left\{{}\begin{matrix}n_{OH^-}=0,08.1.1=0,08\left(mol\right)\\n_{H^+}=0,12.0,25.2=0,06\left(mol\right)\end{matrix}\right.\)
⇒ OH- dư
\(\Rightarrow\left[OH^-\right]=\dfrac{0,08-0,06}{0,08+0,12}=0,1M\)
\(\Rightarrow pH=14+log\left(0,1\right)=13\)

nH2SO4 = 0,002.0,4 = 0,0008 mol=> nH+ = 0,0016 moll
nNaOH = 0,001.0,6 = 0,0006 mol = nOH-
H+ + OH- → H2O
=> H+ dư = 0,0016 - 0,0006 = 0,001 mol
V dung dịch = 400 + 600 = 1000 ml = 1 lít
=> [H+] = \(\dfrac{0,001}{1}\)= 10-3 => pH = 3

Đáp án B
nOH-= 0,03 mol; nBa2+ = 0,01 mol
nH+ = 0,035 mol; nSO4(2-) = 0,015 mol
H+ + OH- → H2O
0,035 0,03
nH+ dư = 5.10-3 mol; [H+] dư = 5.10-3/0,5 = 0,01 suy ra pH = 2

\(pH=2\Rightarrow\left[H^+_{dư}\right]=10^{-2}\Rightarrow n_{H^+}=10^{-2}\left(V+0,4\right)\)
\(n_{H^+}=2.0,0375.0,4+0,0125.0,4=0,035\left(mol\right)\)
\(n_{OH^-}=0,3V\left(mol\right)\)
\(\Rightarrow0,035+0,3V=10^{-2}\left(V+0,4\right)\)
\(\Rightarrow V=33,1\left(l\right)\)
\(\Leftrightarrow V=\)

Có:nH2SO4 =0,02(mol) ; nHCl=0,04(mol)
=>nH(+)=0,08(mol)
Có: nBa(OH)2 =0,045 (mol); nNaOH=0,03(mol)
=>nOH(-)=0,12(mol)
H(+) +OH(-) ------>H2O
0,008-----0,008
=>nOH(-) dư=0,04(mol)
[OH(-) dư]=0,04/0,5=0,08(M)
=>pH= -log(0,08) =1,1
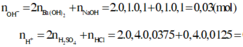
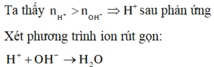
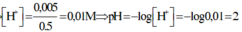
nh+=0,4.2.0,25=0,2 mol
noh-=0,5.0,06=0,03 mol
nh+ dư=0,17 mol
suy ra nồng độ h+=0,17/0,4=0,425 M
ph=-lg0,425=0,37
bạn ơi cho mình hỏi nhé ! l khi số mol NaOH nhìu hơn thì phải làm sao