Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Gọi: x là % nguyên tử \(\frac{35}{17}Cl\) và (100-x ) là % nguyên tử \(\frac{37}{17}Cl\)
Ta có : x + y = 100 (1)
Mặt khác :
\(\overline{M}=\frac{35x+37y}{100}=35.5\)
<=> 35x + 37y = 3550 (2)
Giải (1) và (2) :
x = 75
y = 25
Vậy: \(\frac{37}{17}Cl\) chiếm 25% khối lượng trong phân tử HClO4

Đặt X là số oxi hoá của nguyên tố ni tơ trong các hợp chất trên ta có
Trong NO: x + (-2) = 0 -> X = +2
Trong NO2: x + 2(-2) = 0 -> x = +4
Trong N2O5 : 2x + 5(-2) = 0 \(\rightarrow\) x = +5
Trong HNO3 : (+1) + x + 3(-2) = 0 \(\rightarrow\) X = +5
Trong HNƠ2 : (+1) + x + 2(-2) = 0 \(\rightarrow\) X = +3
Trong NH3 : X + 3(+l) = 0 \(\rightarrow\) X = -3
Trong NH4Cl: X + 4(+l) + (-1) = 0 \(\rightarrow\) X = -3.
Cũng giải tương tự như trên ta có:
.jpg)
- Đặt x là oxi hóa của nguyên tố nitơ trong các hợp chất trên, ta có:
Trong NO: x + (-2) = 0 → x = +2.
Trong NO2: x + 2(-2) = 0 → x = +4.
Trong N2O5: 2x + 5(-2) = 0 → x = +5.
Trong HNO3: (+1) +x + 3(-3) = 0 → x = +5.
Trong HNO2: (+1) + x +2(-2) = 0 → x = +3.
Trong NH3 : x + 3(+1) = 0 → x = -3.
Trong NH3Cl: x + 4(+1) +(-1) = 0 → x = -3.
- Cũng giải tương tự như trên ta có:

Gọi x y là phần trăm của cl 35 37
Giải hpt 35x+37y= 35.5 x+y=1
y=0.25
%cl trong hclo4= 35.32%
%cl 37= 35.32%.0.25= 8.83%

Câu nào đúng, câu nào sai trong các câu sau đây :
A. Sự oxi hoá một nguyên tố là lấy bớt electron của nguyên tố đó, là làm cho số oxi hoá của nguyên tố đó tăng lên.
=> Đúng
B. Chất oxi hoá là chất thu electron, là chất chứa nguyên tố mà số oxi hoá của nó tăng sau phản ứng.
=> Sai
C. Sự khử một nguyên tô là sự thu thêm electron cho nguyên tố đó, làm cho số oxi hoá của nguyên tố đó giảm xuống.
=> Đúng
D. Chất khử là chất thu electron, là chất chứa nguyên tố mà số oxi hoá của nó giảm sau phản ứng.
=> Sai

a) Số oxi hoá của cacbon trong :
\(CO\Rightarrow C^{+2}\)
\(CO_2\Rightarrow C^{+4}\)
\(C_2H_5OH\Rightarrow C^{-2}\)
\(CH_4\Rightarrow C^{-4}\)
b) Số oxi hoá của oxi trong :
\(O_2\Rightarrow O^0\)
\(O_3\Rightarrow O^0\)
\(H_2O\Rightarrow O^{-2}\)
\(H_2O_2\Rightarrow O^{-1}\)
c) Số oxi hoá của nitơ trong :
\(NO\Rightarrow N^{+2}\)
\(N_2\Rightarrow N^0\)
\(C_2N_2\Rightarrow N^{-3}\)
\(N_2O\Rightarrow N^{+1}\)

a) Số oxi hóa của S trong các chất: H2, S-2 , S0, H2S+4O3, H2S+6O4
b) Số oxi hóa của Cl trong các hợp chất: HCl-1, HCl+1O, NaCl+3O2, HCl+5O3, HCl+7O4.
c) Số oxi hóa của Mn trong các chất: Mn0, Mn+2Cl2, Mn+4O2, KMn+7O4
d) 

Bài 1:
Gọi x là số khối của đồng vị thứ 2, ta có:
\(\frac{107.56\%+x44\%}{100\%}=107,88\)
\(\Rightarrow x=109\)
Vậy số khối của đồng vị thứ 2 là 109
Nếu có 500 nguyên tử Ag thì số nguyên tử của đồng vị thứ 2 là: \(\frac{44\%.500}{100\%}=220\) (nguyên tử)
\(M_{Ag^{ }_2O}=\left(107,88.2\right)+16=231,76\)
\(\Rightarrow n=\frac{57,94}{231,76}=0,25\left(mol\right)\)
Xét trong 1 mol Ag2O có \(\begin{cases}2molAg\\1molO\end{cases}\)
\(\Rightarrow\) trong 0,25 mol Ag2O có 0,5 mol Ag
\(\Rightarrow\) trong 0,5 mol Ag có \(\frac{56\%.0,5}{100\%}=0.28\left(mol\right)\) đồng vị 107Ag
\(\Rightarrow m_{^{107}Ag}\) = 107 . 0,28 = 29,96 (gam)
Bài 2:
a) Gọi x, y lần lượt là % về số nguyên tử của 2 đồng vị 35Cl và 37Cl, ta có:
\(\begin{cases}x+y=100\\\frac{35x+37y}{100}=35,5\end{cases}\)\(\Leftrightarrow\)\(\begin{cases}x=75\\y=25\end{cases}\)
Vậy đồng vị 35Cl chiếm 75%; đồng vị 37Cl chiếm 25%
b) Tính % về gì vậy bạn?
c) \(M_{AlCl_3}\) = 27 + (35,5 .3) = 133,5
\(\Rightarrow n_{AlCl_3}\) = \(\frac{13,35}{133,5}=0,1\left(mol\right)\)
Xét trong 1 mol AlCl3 có \(\begin{cases}1molAl\\3molCl\end{cases}\)
=> trong 0,1 mol AlCl3 có 0,3 mol Cl
=> trong 0,3 mol Cl có \(\frac{75\%.0,3}{100\%}=0,225\left(mol\right)\) đồng vị 35Cl
=> Số nguyên tử 35Cl có trong 13,35g AlCl3 là:
0,225 . 6,02 . 1023 = 1,3545.1023 (nguyên tử)
1)Cách 1: nhẩm nhanh cho các bài có Z nhỏ, Z lớn vẫn có thể áp dụng nếu bạn gần như đã thuộc bảng tuần hoàn-để có thể suy ra đáp án :d) lấy 10/3 xấp xỉ 3,333 => lấy số gần nhất là 3 tương đương với Z của Nguyên tử cần tìm => Li (giải thích: tổng 3 hạt là E,N,P trong đó E P bằng nhau(, N thì lớn hơn hoặc bằng P, nên muốn tìm Z (Z = E =P) thì chia 3 ra (3 hạt), lấy số đó hoặc phần nguyên nếu lẻ), Z nhỏ thì NP không khác nhau nhiều, còn Z lớn ví dụ (Fe Z=26, N=30, tổng số hạt là 82 chia 3 ra thì là 27,333...không còn đúng nữa.!
Cách 2: cách chính quy dùng cho Kt trên lớp, kiếm điểm:D:
3≤ (2Z+N)/Z < 3,5 (*)=> 2,8...<Z<3,33... => Z=3 (Li) cách này áp dụng cho mọi bài tập dạng này. để hiểu rõ hơn vì sao có công thức (*) bạn nghiên cứu thêm bài tập 1.19 trong sách bài tập hóa lớp 10 trang 6.
2)Mtb= 109*44%+X*(100-44)%=107,88 => X=107

Câu 1: Các nguyên tố nhóm VIIA có cấu hình electron lớp ngoài cùng dạng tổng quát là
A. 3s23p5 B. 2s22p5 C. 4s24p5 D. ns2np5
Câu 2: Halogen nào sau đây ở nhiệt độ thường là chất khí màu lục nhạt, rất độc?
A.Clo. B. Brom. C. Flo. D. Iot.
Câu 3: Tính chất vật lý đặc biệt của iot là
A. tan nhiều trong nước B. Dễ chảy rữa C. dễ thăng hoa D. Màu nâu đỏ
Câu 4: Phi kim nào sau đây là chất lỏng màu đỏ nâu, dễ bay hơi, rất độc?
A.Clo. B. oxi. C. Brom. D. Hidro.
Câu 5: Liên kết trong phân tử của các đơn chất halogen là
A. liên kết cộng hoá trị có cực. B. liên kết cộng hóa trị không có cực.
C. liên kết kim loại D. liên kết ion.
Câu 6: Tính chất hóa học đặc trưng của nhóm halogen là
A. tính khử B. Không có tính khử và không có tính oxi hóa.
C. Tính oxi hóa D. vừa có tính khử, vừa có tính oxi hóa
Câu 7:Dãy các nguyên tố halogen có tính oxi hóa tăng dần là
A. Cl, F, Br, I B. Cl, Br, I, F C. I, Br, Cl, F D. Br, I, F, ClCâu
Câu 11: Cho từng chất KMnO4, MnO2, KClO3, K2Cr2O7 có cùng số mol tác dụng hoàn toàn với dung dịch HCl đặc, dư thì chất cho lượng khí Cl2 ít nhất là:
A. KMnO4 B. MnO2 C. KClO3 D. K2Cr2O7
Câu 12: Trong phòng thí nghiệm, Clo thường được điều chế theo phản ứng
HClđặc + KMnO4 → KCl + MnCl2 + Cl2 + H2O
Hệ số cân bằng của phương trình trên lần lượt là
A. 16; 2; 2; 2; 5; 8 B. 8; 2; 5; 2; 2; 4 C. 2; 16; 2;2; 5; 8 D. 16; 5; 2; 2; 8; 2
Câu 13: Trong phòng thí nghiệm, Clo thường được điều chế theo phản ứng
HClđặc + MnO2 → MnCl2 + Cl2 + H2O
Hệ số cân bằng của phương trình trên lần lượt là
A. 4; 1; 1;1; 2 B. 4; 2; 2; 2; 1 C. 2; 4; 2;2; 1 D. 1; 4; 1; 1; 2
Câu 14: Thành phần chính của nước javen là:
A. NaCl và NaClO. B. NaCl và HclO C. NaClO. D. NaCl.
Câu 15: Hiện tượng xảy ra khi nhỏ dung dịch AgNO3 vào dung dịch NaI
A. Xuất hiện kết tủa màu trắng B. Xuất hiện kết tủa màu vàng nhạt
C. Xuất hiện kết tủa màu vàng đậm D. Không có hiện tượng gì
Câu 16: Chất nào sau đây không tác dụng với dd HCl?
A. Fe. B. Cu. C. AgNO3. D. CaCO3
1D, 2A, 3C, 4C, 5B, 6C, 7C, 8C, 9B, 10A, 11D, 12A, 13A, 14A, 15C, 16B

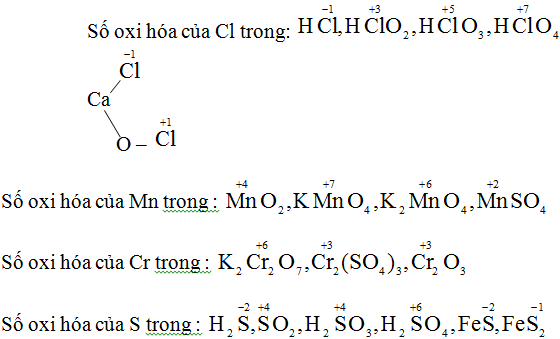
Đáp án C