Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Chứng minh được Al dư,
Áp dụng định luật bảo toàn e: Khi Al p.ư với Cr2O3, 3nAlp.ư = 2.3.nCr2O3 → nAlp.ư = 0,06 mol.
Khi Al dư và Al2O3 p.ư với HCl: 3nAl dư + 2nCr = 2nH2 → nAl dư = 0,02 mol.
Vậy tổng số mol Al là 0,08 mol. Sau tất cả các p.ư Al chuyển thành NaAlO2 nên nNaOH = 0,08.

Chọn C
Gọi công thức của X là RCOOCH2R’ → ancol Z là R’CH2OH
Xét T:
R’CH2OH + 1/2O2 → R’CHO + H2O
R’CH2OH + O2 → R’COOH + H2O
Trong 1/3 T có: R’CHO: x mol; R’COOH: y mol; R’CH2OH dư: z mol; H2O: x +y mol
+) Phần 1 + AgNO3/NH3 → n(Ag) = 2n(R’CHO) = 0,2 mol → x = 0,1 mol
+) Phần 2 + NaHCO3 → n(CO2) = n(R’COOH) = 0,1 mol → y =0,1 mol
+) Phần 3 + Na → n(H2) = ½ n(R’COOH) + ½ n(R’CH2OH) + ½ n(H2O) → z = 0,1 mol
Mặt khác: 25,8 gam chất rắn = m(R’COONa) + m(R’CH2OH) + m(NaOH)
→ 25,8 = 0,1*(R’+44+23) + 0,1*(R’+14+16+23) + 0,2*40 → R’ = 29 (C2H5)

Đáp án C
Xử lí dự kiện Y:
+ Xét phần 1: đặt n C O 3 2 - p u = x ; n H C O 3 - = y
![]()
![]()
trong Y: n C O 3 2 - : n H C O 3 - = 3 : 2
+ Xét phần 2:
n C O 3 2 - = n H + - n C O 2 = 0 , 06 m o l
⇒ n H C O 3 - = 0 , 04 m o l
⇒ trong Y ban đầu chứa 0,12 mol C O 3 2 - và 0,08 mol H C O 3 -
⇒ Quy hỗn hợp về Na, Ba, O
Bảo toàn nguyên tố Ba và Cacbon:
n B a = n B a C O 3 = 0 , 32 - 0 , 12 - 0 , 08 = 0 , 12
Bảo toàn điện tích:
n N a = n N a + = 0 , 32 m o l
Bảo toàn e: n N a + 2 n B a = 2 n O + 2 n H 2
![]()

Chọn đáp án C
Có 2 chất thỏa mãn hai điều kiện là p-HO-CH2-C6H4-OH và m-HO-CH2-C6H4-COOH

Chọn đáp án B.
Áp dụng định luật bảo toàn khối lượng có: m Y = m X
⇒ m Y = 44.0 , 08 + 52.0 , 06 + 2.0 , 15 = 6 , 94 g ⇒ n Y = 6 , 94 347 14 .2 = 0 , 14 m o l
n H 2 phan ung = n X − n Y = 0 , 06 + 0 , 06 + 0 , 15 − 0 , 14 = 0 , 15 m o l
Þ H2 phản ứng hết.
Kết tủa A gồm Ag, A g C ≡ C C H = C H 2 , AgC ≡ CCH 2 CH 3
Có 5 6 .0 , 12 = 0 , 1 > 0 , 06 ⇒ Chứng tỏ có 0,1 mol Ag (tạo bởi 0,05 mol CH3CHO dư).
Đặt số mol của A g C ≡ C C H = C H 2 , AgC ≡ CCH 2 CH 3 lần lượt là a, b
⇒ a + b = 0 , 12 − 0 , 1 = 0 , 02 m o l (1)
Áp dụng định luật bảo toàn liên kết π có: 0 , 08 + 3.0 , 06 = 0 , 15 + 0 , 06 + 3 a + 2 b
⇒ 3 a + 2 b = 0 , 05 (2)
Từ (1) và (2) suy ra a = b = 0 , 01
⇒ m ket tua = 108.0 , 1 + 159.0 , 01 + 161.0 , 01 = 14 g
Gần nhất với giá trị 14,1

nFe= (dfrac{6,72}{56})= 0,12 (mol)
2 Fe + 6 H2SO4(đặc,nóng) → Fe2(SO4)3 + 3 SO2↑ + 6 H2O
mol 0,12 0,3
p.ứ 0,1 0,3
sau p.ứ 0,02 0 0,05
Vậy sau p.ứ thu đc 0,05 mol Fe2(SO4)3 và 0,02 mol Fe dư (ý B)
Bài làm của e chưa chính xác. Đối với trường hợp này thì Fe dư sẽ tiếp tục tác dụng với Fe2(SO4)3 để tạo ra FeSO4. Sản phẩm muối của bài này gồm có : Fe2(SO4)3 và FeSO4

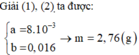


em năm nay mới lên lớp chín mong ad thông cảm
em bt thế nào anh cũng đến mà :))))