Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Có thể xem công thức Fe3O4 là FeO.Fe2O3 nên hỗn hợp X có thể được xem như gồm FeO và Fe2O3.
Gọi a là số mol FeO, b là số mol Fe2O3 của 0,5 m gam X.
FeO + H2SO4 --->FeSO4 + H2O
Fe2O3 + 3H2SO4 ---> Fe2(SO4)3 + 3H2O
từ khối lượng muối khan ở phần 1, ta có phương trình
152a + 400b = 31,6 gam (1)
Phần 2 khi cho Cl2 vào thì xảy ra pu:
FeSO4 + 0,5 Cl2 ---> 1/3 Fe2(SO4)3 + 1/3 FeCl3
--> khối lượng muối ở phần 2 = 400a/3 + 162,5a/3 + 400b = 33,375 gam
--> 562a + 1200b = 100,125 (2)
Từ (1) và (2) suy ra :
a =0,0502358 mol
b = 0,0599153 mol
--> Khối lượng hỗn hợp X = 2 x (72 x 0,0502358 + 160 x 0,0599153) = 26,712448 gam
a.
Phương trình
+ Khi hòa A bằng axit H2SO4 loãng
FeO + H2SO4 \(\rightarrow\) FeSO4 + H2O (1)
Fe2O3 + 3H2SO4 \(\rightarrow\) Fe2(SO4)3 + 3H2O (2)
Fe3O4 + 4H2SO4 \(\rightarrow\) Fe2(SO4)3 + FeSO4+ 3H2O (3)
Sau phản ứng dung dịch chỉ có 2 muối (x+z)mol FeSO4 và (y+z) mol Fe2(SO4)3
+ Khi sục khí Cl2 vào dung dịch sau phản ứng chỉ có FeSO4 phản ứng
6FeSO4 + 3Cl2 \(\rightarrow\) 2FeCl3 + 2Fe2(SO4)3 (4)
b.
Theo bài ta có hệ phương trình
\(\begin{cases}72x+160y+232z=m\text{/}2\\152\left(x+z\right)+400\left(y+z\right)=31,6\\187,5\left(x+z\right)+400\left(y+z\right)=33,375\end{cases}\)\(\begin{matrix}\left(I\right)\\\left(II\right)\\\left(III\right)\end{matrix}\)
Từ II, III ta có x+z= 0,05; y+z=0,06
Mặt khác từ I ta có m=2.[ 72(x+z) + 160(y+z)]=26,4 gam
Vậy m= 26,4g
\(C_{FeSO_4}\)=0,2M; \(C_{Fe_2\left(SO_4\right)_3}\)=0,24M

Câu 1:
Cho giấy quỳ tím ẩm vào ba lọ khí trên:
- Khí nào trong lọ làm đổi màu quỳ tím thành đỏ là khí HCl.
- Khí nào trong lọ tẩy trắng giấy quỳ là khí Cl2.
- Khí nào trong lo không làm đổi màu quỳ tím là khí oxi (dùng que đóm còn than hồng để thử lại).
Câu 2:
Áp dụng CT:
\(C\%=\frac{100.T}{100+T}\)
\(\Leftrightarrow C\%=\frac{40.100}{140}=28,57\%\)
Câu 3:
Gọi số mol Cl2 phản ứng là a
\(2NaBr+Cl_2\rightarrow2NaCl+Br_2\)
\(2KBr+Cl_2\rightarrow2KCl+Br_2\)
\(\Rightarrow n_{Br2}=n_{Cl2}=a\left(mol\right)\)
Gọi khối lượng NaBr và KBr là m
Nên khối lượng NaCl và KCl là m - 4,45
BTKL:
\(71a+m=m-4,45+160a\)
\(\Leftrightarrow a=0,05\left(mol\right)\)
\(\Rightarrow V_{Cl2}=0,05.22,4=1,12\left(l\right)\)
Câu 4:
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(Fe_3O_4+8HCl\rightarrow FeCl_2+2FeCl_3+4H_2O\)
\(AlCl_3+4NaOH\rightarrow NaAlO_2+3NaCl+2H_2O\)
\(FeCl_3+3NaOH\rightarrow Fe\left(OH\right)_3+3NaCl\)
\(FeCl_2+2NaOH\rightarrow Fe\left(OH\right)_2+2NaCl\)
\(2Fe\left(OH\right)_2\rightarrow Fe_2O_3+3H_2O\)
\(Fe\left(OH\right)_2+O_2\rightarrow2Fe_2O_3+4H_2O\)
Kết tủa là Fe2O3
Bảo toàn e:
\(\Rightarrow n_{Fe}=2n_{Fe2O3}\)
\(\Leftrightarrow0,2+0,2.3=2n_{Fe2O3}\)
\(\Leftrightarrow n_{Fe2O3}=0,4\left(mol\right)\)
\(\Rightarrow m_{Fe2O3}=0,4.160=64\left(g\right)\)
Câu 5:
Ta có:
\(\frac{n_{FeCl3}}{n_{CuCl2}}=\frac{2n_{Fe2O3}}{n_{CuO}}=\frac{1}{2}\)
\(\Rightarrow\frac{n_{Fe2O3}}{n_{CuO}}=\frac{1}{2}\)
\(\Rightarrow\left\{{}\begin{matrix}\%m_{CuO}=\frac{80.3}{80.2+160}=50\%\\\%m_{Fe2O3}=100\%-50\%=50\%\end{matrix}\right.\)

\(Mg+H_2SO_4\rightarrow MgSO_4+H_2\uparrow\)
a a a a (mol)
\(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\uparrow\)
b \(\dfrac{3}{2}b\) \(\dfrac{1}{2}b\) \(\dfrac{3}{2}b\) (mol)
n\(_{H_2}=\dfrac{8,96}{22,4}=0,4\left(mol\right)\)
gọi số mol của Mg trong hỗn hợp là a;Al là b,ta có hệ phương trình:
\(\left\{{}\begin{matrix}a+\dfrac{3}{2}b=0,4\\24a+27b=7,8\end{matrix}\right.\)
\(\Leftrightarrow\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
m\(_{Mg}=0,1.24=2,4\left(g\right)\)
\(\rightarrow m_{Al}=7,8-2,4=5,4\left(g\right)\)
b/
\(V_{H_2SO_4}=\dfrac{0,1+0,3}{2}=0,2\left(l\right)=200\left(ml\right)\)
2/
\(Cu+2H_2SO_{4\left(đn\right)}\rightarrow CuSO_4+SO_2+2H_2O\)
0,2 0,2 (mol)
\(n_{Cu}=\dfrac{12,8}{64}=0,2\left(mol\right)\)
m\(_{ddNaOH}=1,28.125=160\left(g\right)\)
\(m_{NaOH}=\dfrac{160.25}{100}=40\left(g\right)\)
\(n_{NaOH}=\dfrac{40}{40}=1\left(mol\right)\)
\(T=\dfrac{n_{NaOH}}{n_{SO_2}}=\dfrac{1}{0,2}=5\)
vậy phản ứng sẽ tạo ra muối natri sulfit(\(Na_2SO_3\)) và dư NaOH:
\(2NaOH+SO_2\rightarrow Na_2SO_3+H_2O\)
bđ: 1 0,2 0 (mol)
pư: 0,4 0,2 0,2 (mol)
dư: 0,6 0 0 (mol)
\(C_{M_{Na_2SO_3}}=\dfrac{0,2}{0,125}=1,6\left(M\right)\)

1) Ptpư:
2Al + 6HCl \(\rightarrow\) 2AlCl3 + 3H2
Fe + 2HCl \(\rightarrow\) FeCl2 + H2
Cu + HCl \(\rightarrow\) không phản ứng
=> 0,6 gam chất rắn còn lại chính là Cu:
Gọi x, y lần lượt là số mol Al, Fe
Ta có:
3x + 2y = 2.0,06 = 0,12
27x + 56 y = 2,25 – 0,6 = 1,65
=> x = 0,03 (mol) ; y = 0,015 (mol)
=> \(\%Cu=\frac{0,6}{2,25}.100\%=26,67\%\); \(\%Fe=\frac{56.0,015}{2,25}.100\%=37,33\%\); %Al = 36%
2) \(n_{SO_2}=\frac{1,344}{22,4}=0,06mol\); m (dd KOH) = 13,95.1,147 = 16 (gam)
=> mKOH = 0,28.16 = 4,48 (gam)=> nKOH = 0,08 (mol)=> \(1<\)\(\frac{n_{KOH}}{n_{SO_2}}<2\)
=> tạo ra hỗn hợp 2 muối: KHSO3: 0,04 (mol) và K2SO3: 0,02 (mol)
Khối lượng dung dịch sau pu = 16 + 0,06.64 = 19,84 gam
=> \(C\%\left(KHSO_3\right)=\frac{0,04.120}{19,84}.100\%\)\(=24,19\%\)
\(C\%\left(K_2SO_3\right)=\frac{0,02.158}{19,84}.100\%\)\(=15,93\%\)

bài 1
Gọi số mol Cl2 và O2 lần lượt là x , y
=> x + y = 0,3 mol (1)
Ta có:
Bảo toàn e: ∑ne cho = ∑ne nhận
=> 2x+4y = 0,8 (2)
Từ (1) và (2) => x = 0,2 và y = 0,1
=> %mO2 = 0,1.32 : (0,1.32 + 0,2.71).100 = 18,4%
bài 2
Có:
Áp dụng định luật bảo toàn khối lượng ta có:
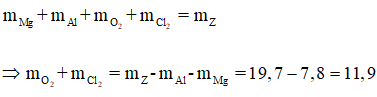
Gọi
Có:
Gọi
Có
Vậy

\(Fe_2O_3+6HCl-->2FeCl_3+3H_2O\left(1\right)\)
0,05_______0,3_______0,1
\(n_{Fe_2O_3}=\frac{8}{160}=0,05\left(mol\right)\)
a) \(m_{FeCl_3}=0,1.162,5=16,25\left(g\right)\)
b)
\(V_{HCl}=\frac{0,3}{0,5}=0,6\left(M\right)\)
c) \(C_{M_{FeCl_3}}=\frac{0,1}{0,5}=0,2\left(M\right)\)
a)
\(n_{Fe2O3}=\frac{8}{160}=0,05\left(mol\right)\)
\(Fe_2O_3+6HCL\rightarrow2FeCl_3+3H_2O\)
0,05_______0,3______ 0,1____________
\(m_{FeCl3}=0,1.26,5=16,25\left(g\right)\)
b)
\(V_{HCL}=\frac{0,3}{0,5}=0,6\left(l\right)\)
c)
\(CM_{HCl}=\frac{0,1}{0,6}=\frac{1}{6}M\)

1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi \(\rightarrow\) (hỗn hợp oxit ) + axit \(\rightarrow\) muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=> \(n_O=\frac{9,6}{16}=0,6mol\)
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 \(\rightarrow\) xM + yH2O (1)
\(n_{H_2}=\frac{985,6}{22,4.1000}=0,044\left(mol\right)\)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl \(\rightarrow\) 2MCln + nH2 (2)
\(n_{H_2}=\frac{739,2}{22,4.1000}=0,033\left(mol\right)\)
(2) => \(\frac{1,848}{M}.n=2.0,033\)
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1) \(\frac{x}{y}=\frac{n_M}{n_{H_2}}=\frac{0,033}{0,044}=\frac{3}{4}\)
=> oxit cần tìm là Fe3O4
1.a. Sơ đồ các quá trình phản ứng
Kim loại + Oxi (hỗn hợp oxit ) + axit muối + H2O
Từ quá trình trên => số mol H2SO4 phản ứng = số mol oxi trong oxit
Theo bài ta có: moxi = 39,2 – 29,6 = 9,6(g)
=>
=> số mol H2SO4 phản ứng = 0,6 (mol)
b. Khối lượng muối = khối lượng kim loại + khối lượng gốc sunfat
=> mm = 29,6 + 96. 0,6 = 87,2 (g)
2. Gọi công thức của oxit cần tìm là MxOy
Phương trình phản ứng.
MxOy + yH2 xM + yH2O (1)
Theo định luật bảo toàn khối lượng
=> khối lượng kim loại = 2,552 + 0,044.2 – 0,044.18 = 1,848(g)
Khi M phản ứng với HCl
2M + 2nHCl 2MCln + nH2 (2)
(2) =>
=> M = 28n
Với n là hóa trị của kim loại M
Chỉ có n = 2 với M = 56 (Fe) là thỏa mãn
Theo (1)
=> oxit cần tìm là Fe3O4