Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

+ Gọi V là thể tích của bình và p n là áp suất gây nổ.
+ Đối với khí nitơ ta có:
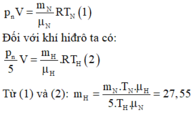

Trạng thái 1 là trạng thái khí ở điều kiện tiêu chuẩn: { V 1 = m p = 3 , 96 1 , 98 m 3 = 2 m 3 p 1 = p 0 = 1 a t T 1 = 0 0 C = 273 K
Trạng thái 2 là trạng thái khí ở điều kiện có thể nổ { V 2 = 0 , 04 m 3 p 2 = 60 a t T 2 = ?
Áp dụng công thức
p 1 V 1 T 1 = p 2 V 2 T 2 ⇒ T 2 = p 2 V 2 T 1 p 1 V 1 = 60.0 , 04.273 1.2 T 2 = 327 , 6 K
Mà T 2 = 273 + t 2 = 327 , 6 K ⇒ t 2 = 54 , 6 0 C

+ Trạng thái 1 là trạng thái khí ở điều kiện tiêu chuẩn:
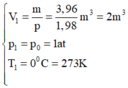
+ Trạng thái 2 là trạng thái khí ở điều kiện có thể nổ:


Bài giải.
+ Trạng thái 1:
p1 = 750 mmHg
T1 = 300 K
V1 = 40 cm3
+ Trạng thái 2 :
P0 = 760 mmHg
T0 = 273 K
V0 = ?
+ Phương trình trạng thái :
\(\dfrac{p_0V_0}{T_0}=\dfrac{p_1V_1}{T_1}\Rightarrow V_0=\dfrac{p_1V_1}{T_1}.\dfrac{T_0}{p_0}\)
\(V_0=\dfrac{750.40.273}{760.300}=36cm^3\)

Áp dụng pt trạng thái: (P1.V1):T1= (P2.V2):T2
<=> (750x40):300= (760.V2):273
Giải pt tìm được V2

Do bình không dãn nở vì nhiệt, nên công do khí sinh ra : A' = p ∆ V = 0. Theo nguyên lí I, ta có :
∆ U = Q (1)
Nhiệt lượng do khí nhận được : Q = m c V ( T 2 - T 1 ) (2)
Mặt khác, do quá trình là đẳng tích nên :
![]()
Từ (2) tính được : Q = 15,58. 10 3 J.
Từ (1) suy ra: ∆ U = 15,58. 10 3 J.
Gọi V là thể tích của bình và pn là áp suất gây nổ.
Đối với khí nitơ ta có: p n V = m N μ N R T N (1)
Đối với khí hiđrô ta có: p n 5 V = m H μ H R T H (2)
Từ (1) và (2) ⇒ m H = m N . T N . μ H 5. T H . μ N = 27 , 55 g