Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Tham khảo:
Hiện tượng: ở đáy cốc xuất hiện chất lỏng màu vàng nhạt.
PTHH: C6H6 + HNO3 → C6H5NO2 + H2O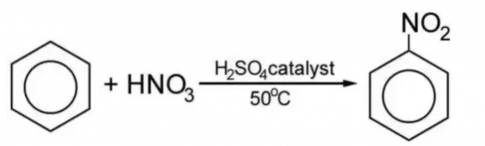
Nitrobenzen có màu vàng nhạt không tan trong nước.

- Trong Thí nghiệm 1, chất lỏng xuất hiện ở đáy cốc không phải là benzene (benzene không màu).
- Vì benzene phản ứng với dung dịch nitric acid tạo nitrobenzene có màu vàng nhạt .
PTHH: C6H6 + HNO3 → C6H5NO2 + H2O

- Tính chất của sulfuric acid loãng:
Dung dịch sulfuric acid loãng có đầy đủ tính chất của một acid mạnh:
+ Đổi màu quỳ tím thành đỏ.
+ Tác dụng với kim loại hoạt động trong dãy hoạt động hoá học.
+ Tác dụng với basic oxide và base.
+ Tác dụng với nhiều muối.
- Tính chất của sulfuric acid đặc: Ngoài tính acid, dung dịch sulfuric acid đặc còn có tính oxi hoá và tính háo nước.
- Cách bảo quản sulfuric acid:
+ Sulfuric acid được bảo quản trong chai, lọ có nút đậy chặt, đặt ở vị trí chắc chắn.
+ Đặt chai, lọ đựng dung dịch sulfuric acid đặc tránh xa các lọ chứa chất dễ gây cháy, nổ như chlorate, perchlorate, permanganate, dichromate.
- Cách sử dụng sulfuric acid để đảm bảo an toàn:
Sulfuric acid gây bỏng khi rơi vào da, do vậy cần tuân thủ các nguyên tắc:
(1) Sử dụng găng tay, đeo kính bảo hộ, mặc áo thí nghiệm.
(2) Cầm dụng cụ chắc chắn, thao tác cẩn thận.
(3) Không tì, đè chai đựng acid lên miệng cốc, ống đong khi rót acid.
(4) Sử dụng lượng acid vừa phải, lượng acid còn thừa phải thu hồi vào lọ đựng.
(5) Không được đổ nước vào dung dịch acid đặc.

Trong 50 ml dd có 1 gam acid.
Ta có: \(n_{NaOH}=0,0327.0,5=0,01635\left(mol\right)\)
\(CH_3COOH+NaOH\rightarrow CH_3COONa+H_2O\)
\(\Rightarrow n_{CH_3COOH\left(trong50ml\right)}=n_{NaOH}=0,01635\left(mol\right)\)
\(\Rightarrow m_{CH_3COOH\left(trong50ml\right)}=0,01635.60=0,981\left(g\right)\)
\(\Rightarrow\%m_{CH_3COOH}=\dfrac{0,981}{1}.100\%=98,1\%\)

- Khối lượng phân tử của axit oxalic ngậm nước \(H_{2} C_{2} O_{4} \cdot 2 H_{2} O\):
\(M = 2 \times 12,011 + 6 \times 1,008 + 6 \times 16,00 \approx 126,07 \&\text{nbsp}; \left(\text{g} \backslash\text{cdotp} \text{mol}\right)^{- 1} .\)
- Số mol trong 1{,}26 g:
\(n_{\text{acid}} = \frac{1,26}{126,07} \approx 0,0099944 \&\text{nbsp};\text{mol} .\)
- Vì hoà thành 100 mL nên nồng độ mol của dung dịch axit ban đầu:
\(C_{\text{acid}} = \frac{0,0099944}{0,100} = 0,099944 \&\text{nbsp};\text{M} .\)
- Lấy 10 mL (0,010 L) mẫu để chuẩn độ nên số mol axit trong mẫu:
\(n_{\text{m} \overset{\sim}{\hat{\text{a}}} \text{u}} = 0,099944 \times 0,010 = 0,00099944 \&\text{nbsp};\text{mol} .\)
- Oxalic acid là axit dị chức (phân 2 H\(^{+}\)), và với chỉ thị phenolphthalein (độ pH ~9) ta đến điểm tương đương thứ hai — tức mỗi mol axit phản ứng với 2 mol NaOH. Vậy số mol NaOH đã phản ứng là:
\(n_{\text{NaOH}} = 2 \times 0,00099944 = 0,00199888 \&\text{nbsp};\text{mol} .\)
- Thể tích NaOH dùng là 17,5 mL = 0,0175 L. Do đó nồng độ mol của dung dịch NaOH:
\(C_{\text{NaOH}} = \frac{0,00199888}{0,0175} \approx 0,11422 \&\text{nbsp};\text{M} .\)
Kết luận: nồng độ dung dịch NaOH \(\approx 0,114 \&\text{nbsp}; \mathbf{M}\) (≈0,1142 M nếu giữ 4 chữ số thập phân).

- Hiện tượng: Đường kính hoặc bột gạo hay bột mì dần dần hoá thành chất rắn màu đen, sau đó trong cốc sủi bọt đẩy chất rắn màu đen trào ra ngoài cốc.
- Giải thích: Các hợp chất đường kính, bột gạo hay bột mì,… (công thức tổng quát có dạng Cn(H2O)m) bị sulfuric acid đặc hút nước tạo ra chất rắn màu đen là carbon. Một phần carbon sinh ra tiếp tục bị oxi hoá bởi sulfuric acid tạo thành khí CO2 và SO2 , đẩy carbon trào ra ngoài cốc.
- Phương trình hóa học:
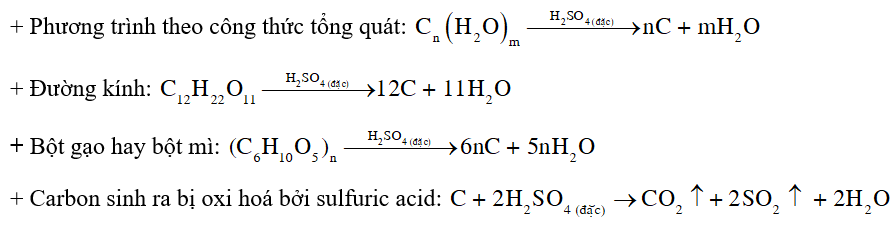

Đáp án đúng là: A