Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 1: Cho dãy dung dịch axit sau HF, HCl, HBr, HI. Dung dịch có tính axit mạnh nhất và tính khử mạnh nhất là:
A. HF
B. HCl
C. HBr
D. HI
Giải thích: Tính khử, tính axit tăng dần theo thứ tự: HF < HCl < HBr < HI
Câu 2: Nung 8,1gam bột nhôm với 38,1gam iot , biết hiệu suất phản ứng là 80%. Lượng Iotua nhôm thu được là :
A. 81,6g
B. 97,92g
C. 65,28g
D. 102g
Giải thích:
\(n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\); \(n_{I_2}=\dfrac{38,1}{254}=0,15\left(mol\right)\)
PTHH: 2Al + 3I2 --H2O--> 2AlI3
Xét tỉ lệ: \(\dfrac{0,3}{2}>\dfrac{0,15}{3}\) => Hiệu suất tính theo I2
\(n_{I_2\left(pư\right)}=\dfrac{0,15.80}{100}=0,12\left(mol\right)\)
PTHH: 2Al + 3I2 --H2O--> 2AlI3
0,12------->0,08
=> mAlI3 = 0,08.408 = 32,64 (g)
=> Không có đáp án thỏa mãn
Câu 3: Khi sục chất khí nào sau đây vào dung dịch KI có hồ tinh bột thì sau phản ứng dung dịch có màu xanh:
A. Cl2
B. O3
C. O2
D. Cl2, O3
Giải thích:
2KI + Cl2 --> 2KCl + I2
2KI + O3 + H2O --> 2KOH + I2 + O2
I2 làm xanh dd hồ tinh bột
Câu 4: Cho NaI rắn vào bình dung dịch H2SO4đđ nóng dư. Sau khi phản ứng kết thúc thêm vài giọt hồ tinh bột vào bình phản ứng thì dung dịch sẽ có màu:
A. Nâu
B. Đỏ
C. Tím
D. Xanh
2NaI + 2H2SO4 --> Na2SO4 + SO2 + I2 + 2H2O
I2 làm xanh dd hồ tinh bột
Câu 5: Tính oxi hóa của Br2:
A. mạnh hơn Flo nhưng yếu hơn Clo.
B. mạnh hơn Clo nhưng yếu hơn Iot.
C. mạnh hơn Iot nhưng yếu hơn Clo.
D. mạnh hơn Flo nhưng yếu hơn Iot.
Giải thích: Tính oxh tăng dần theo thứ tự: I2 < Br2 < Cl2 < F2
Câu 6: Trong phản ứng hóa học sau, Brom đóng vai trò là SO2 + Br2 + 2H2O H2SO4 + 2HBr
A. Chất khử.
B.Vừa là chất oxi hóa vừa là chất khử.
C.Chất oxi hóa.
D.Không là chất oxi hóa không là chất khử.
Giả thích: Br0 bị khử xuống Br-1 => Br2 là chất oxh
Câu 7: Chất khí có thể làm mất màu dung dịch nước Brom là:
A. SO2.
B. CO2.
C. O2.
D. HCl.
Giải thích: SO2 + Br2 + 2H2O --> 2HBr + H2SO4
Câu 8: Đổ dd chứa 1 g HBr vào dd chứa 1 g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu: A
. Màu đỏ.
B. Màu xanh.
C. Không màu.
D. Màu tím.
Giải thích:
\(n_{HBr}=\dfrac{1}{81}\left(mol\right)\); \(n_{NaOH}=\dfrac{1}{40}=0,025\left(mol\right)\)
PTHH: NaOH + HBr --> NaBr + H2O
Xét tỉ lệ: \(\dfrac{\dfrac{1}{81}}{1}< \dfrac{0,025}{1}\) => NaOH dư => QT chuyển xanh
Câu 9: Chất A là muối Canxi halogenua. Dung dịch chứa 0.200 g A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0.376 g kết tủa bạc halogenua. Công thức phân tử của chất A là:
A. CaF2.
B. CaCl2.
C. CaBr2.
D. CaI2.
Giải thích:
nCaX2 = \(\dfrac{0,2}{40+2.M_X}\) (mol)
=> nAgX = \(\dfrac{0,2}{20+M_X}\) (mol)
=> \(M_{AgX}=\dfrac{0,376}{\dfrac{0,2}{20+M_X}}=1,88\left(20+M_X\right)\)
=> MX = 80 (g/mol)
=> X là Br
=> CTHH: CaBr2
Câu 10: Phát biểu nào sau đây không chính xác:
A. Halogen là những phi kim điển hình, chúng là những chất oxi hóa.
B. Trong hợp chất các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7.
C. Khả năng oxi hóa của halogen giảm dần từ flo đến iot
D. Các halogen khá giống nhau về tính chất hóa học.
Giải thích: B sai do Flo chỉ có số oxi hóa là -1
Câu 1: Cho dãy dung dịch axit sau HF, HCl, HBr, HI. Dung dịch có tính axit mạnh nhất và tính khử mạnh nhất là:
A. HF
B. HCl
C. HBr
D. HI
Câu 2: Nung 8,1gam bột nhôm với 38,1gam iot , biết hiệu suất phản ứng là 80%. Lượng Iotua nhôm thu được là :
A. 81,6g
B. 97,92g
C. 65,28g
D. 102g
Câu 3: Khi sục chất khí nào sau đây vào dung dịch KI có hồ tinh bột thì sau phản ứng dung dịch có màu xanh:
A. Cl2
B. O3
C. O2
D. Cl2, O3
Câu 4: Cho NaI rắn vào bình dung dịch H2SO4đđ nóng dư. Sau khi phản ứng kết thúc thêm vài giọt hồ tinh bột vào bình phản ứng thì dung dịch sẽ có màu:
A. Nâu
B. Đỏ
C. Tím
D. Xanh
Câu 5: Tính oxi hóa của Br2:
A. mạnh hơn Flo nhưng yếu hơn Clo.
B. mạnh hơn Clo nhưng yếu hơn Iot.
C. mạnh hơn Iot nhưng yếu hơn Clo.
D. mạnh hơn Flo nhưng yếu hơn Iot.
Câu 6: Trong phản ứng hóa học sau, Brom đóng vai trò là SO2 + Br2 + 2H2O H2SO4 + 2HBr
A. Chất khử.
B.Vừa là chất oxi hóa vừa là chất khử.
C.Chất oxi hóa.
D.Không là chất oxi hóa không là chất khử.
Câu 7: Chất khí có thể làm mất màu dung dịch nước Brom là:
A. SO2.
B. CO2.
C. O2.
D. HCl.
Câu 8: Đổ dd chứa 1 g HBr vào dd chứa 1 g NaOH. Nhúng giấy quì tím vào dung dịch thu được thì giấy quì tím chuyển sang màu: A
. Màu đỏ.
B. Màu xanh.
C. Không màu.
D. Màu tím.
Câu 9: Chất A là muối Canxi halogenua. Dung dịch chứa 0.200 g A tác dụng với lượng dư dung dịch bạc nitrat thì thu được 0.376 g kết tủa bạc halogenua. Công thức phân tử của chất A là:
A. CaF2.
B. CaCl2.
C. CaBr2.
D. CaI2.
Câu 10: Phát biểu nào sau đây không chính xác:
A. Halogen là những phi kim điển hình, chúng là những chất oxi hóa.
B. Trong hợp chất các halogen đều có thể có số oxi hóa: -1, +1, +3, +5, +7.
C. Khả năng oxi hóa của halogen giảm dần từ flo đến iot
D. Các halogen khá giống nhau về tính chất hóa học.

a)
\(n_{HCl}=\dfrac{200.14,6}{100.36,5}=0,8\left(mol\right)\)
\(n_{CO_2}=\dfrac{6,72}{22,4}=0,3\left(mol\right)\)
PTHH: MgCO3 + 2HCl --> MgCl2 + CO2 + H2O
______a--------->2a-------->a-------->a
CaCO3 + 2HCl --> CaCl2 + CO2 + H2O
_b-------->2b-------->b------->b
=> \(\left\{{}\begin{matrix}84a+100b=28,4\\a+b=0,3\end{matrix}\right.=>\left\{{}\begin{matrix}a=0,1\\b=0,2\end{matrix}\right.\)
=> \(\left\{{}\begin{matrix}\%MgCO_3=\dfrac{0,1.84}{28,4}.100\%=29,577\%\\\%CaCO_3=\dfrac{0,2.100}{28,4}.100\%=70,423\%\end{matrix}\right.\)
b) mdd sau pư = 28,4 + 200 - 0,3.44 = 215,2 (g)
\(\left\{{}\begin{matrix}C\%\left(MgCl_2\right)=\dfrac{0,1.95}{215,2}.100\%=4,4\%\\C\%\left(CaCl_2\right)=\dfrac{0,2.111}{215,2}.100\%=10,32\%\\C\%\left(HCl\right)=\dfrac{\left(0,8-2.0,1-2.0,2\right).36,5}{215,2}.100\%=3,39\%\end{matrix}\right.\)

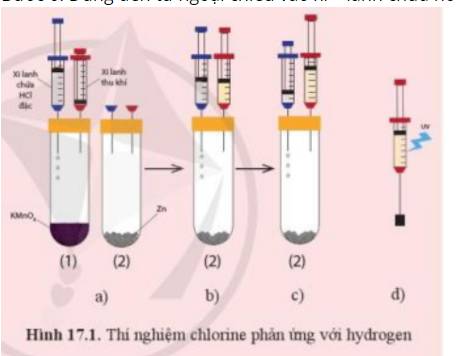
a)
- Ở Bước 2: Ta thu được khí chlorine
- Ở Bước 4: Ta thu được khí hydrogen
=> Trong xi – lanh là hỗn hợp kí chlorine và hydrogen
- Khi chiếu đèn tử ngoại vào xi – lanh hoặc dùng ngọn lửa hơ nhẹ bên ngoài xi - lanh chứa hỗn hợp khí chlorine và hydrogen sẽ gây ra hiện tượng nổ
- Phương trình hóa học: H2 + Cl2 → 2HCl
b) Nếu thay khí chlorine bằng hơi iodine thì phản ứng giữa hơi iodine và hydrogen không xảy ra hiện tượng như trên.
- Giải thích: Phản ứng giữa H2 và I2 cần đun nóng để phản ứng diễn ra, là phản ứng thuận nghịch, tạo hỗn hợp gồm HI sinh ra và lượng H2, I2 còn lại. Khả năng phản ứng kém nên không có hiện tượng nổ
H2 + I2 \( \rightleftharpoons \) 2HI

\(M+H_2O\rightarrow MOH+\dfrac{1}{2}H_2\)
\(n_{H_2}=\dfrac{2,24}{22,4}=0,1\left(mol\right)\)
Ta có: \(n_M=2n_{H_2}=0,2\left(mol\right)\)
\(\Rightarrow M_M=\dfrac{4,6}{0,2}=23\left(Na\right)\)
\(Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\)
0,2......................0,2..........0,1
TH1: HCl dư sau phản ứng
\(NaOH+HCl\rightarrow NaCl+H_2O\)
0,2..............0,2..............0,2
\(m_{NaCl}=0,2.58,5=11,7\) (g) > m chất tan
=> Loại
TH2: NaOH dư
Gọi x là số mol HCl phản ứng
\(NaOH+HCl\rightarrow NaCl+H_2O\)
x.................x.............x
Ta có : \(m_{ct}=\left(0,2-x\right).40+x.58,8=10,96\)
=> x = 0,16
=> \(V=\dfrac{0,16}{1}=0,16\left(l\right)\)

\(n_{HCl}=\dfrac{200.14,6\%}{36,5}=0,8\left(mol\right)\\ Đặt:\left\{{}\begin{matrix}n_{Zn}=x\left(mol\right)\\n_{Mg}=y\left(mol\right)\end{matrix}\right.\\ Zn+2HCl\rightarrow ZnCl_2+H_2\\ Mg+2HCl\rightarrow MgCl_2+H_2\\ Tacó:\left\{{}\begin{matrix}65x+24y=12,5\\x+y=0,35\left(mol\right)\end{matrix}\right.\\ \Rightarrow\left\{{}\begin{matrix}x=0,1\\y=0,25\end{matrix}\right.\\ \Rightarrow m_{Zn}=6,5\left(g\right);m_{Mg}=6\left(g\right)\\ b.Tacó:BTNT\left(H\right):n_{HCl}.1>n_{H_2}.2\\ \Rightarrow HCldưsauphảnứng\\ Dungdịchsauphảnứnggồm:\left\{{}\begin{matrix}ZnCl_2:0,1\left(mol\right)\\MgCl_2:0,25\left(mol\right)\\HCl_{dư}:0,8-0,7=0,1\left(mol\right)\end{matrix}\right.\\ m_{ddsaupu}=200+12,5-0,35.2=212,8\left(g\right)\\ C\%_{ZnCl_2}=\dfrac{0,1.136}{212,8}.100=6,39\%;C\%_{MgCl_2}=\dfrac{0,25.95}{212,8}.100=11,16\%;C\%_{HCl\left(dư\right)}=\dfrac{0,1.36,5}{212,8}.100=1,72\%\)

Chọn đáp án B
1. Đúng.
2. Sai.HF là axit rất yếu.Ăn mòn thủy tinh là tính chất riêng có.
3. Sai.Tính khử và tính axit tăng dần
4. Sai điều chế bằng điện phân dung dịch NaCl không có màng ngăn.
5. Sai HClO là axit rất yếu

Bạn tham khảo ở đây nha:Câu hỏi của Lê Quang Hiếu - Hóa học lớp 12 | Học trực tuyến
vì K+ và Na+ nên viết p.tử không chuẩn
a) khi cho H+ từ từ vào CO32- và HCO3- thì H+ td với CO32- trước vì nộng độ H+trong dd mới tạo thành nhỏ nên sẽ tác dụng từng nấc(vì chỉ từng giọt).lượng H+ chưa dư khi tác dụng với CO32- nên không thể tác dụng tiếp với HCO3- dẫn đến không có hiện tượng
H++CO32- -->HCO3-
b) khi cho H+ từ từ vào CO32- và HCO3- thì H+ td với CO32- trước. H+ tác dụng với CO32- còn dư tác dụng với 1 phần HCO3- tạo CO2 khí ko màu dd còn HCO3- tác dụng với OH- tạo CO32- td Ba2+ tạo kt trắng BaCO3
CO32-+H+-->HCO3-
HCO3-+H+-->H2O+CO2
HCO3-+OH-+Ba2+-->BaCO3+H2O(dư nên khi vậy ko dư ghi tỉ lệ Ba2+:OH-=1:2)
c)cho từ từ CO32- và HCO3- vào H+ thì pứ xảy ra đồng thời tạo đều tạo khí CO2 vì khi cho vào thì mt có nồng độ H+ lớn nên pứ xảy ra theo 2 nấc đồng thời
CO32-+2H+-->H2O+CO2
HCO3-+H+-->H2O+CO2
- Tính acid phụ thuộc vào khả năng tách H của acid. Phân tử nào càng dễ tách H thì tính acid càng mạnh
- Trong nhóm halogen, từ F đến I có độ âm điện giảm dần
=> Khả năng liên kết H-X giảm dần
=> Khả năng tách H trong HX tăng dần
=> Tính acid tăng dần
=> Dung dịch HF có tính acid yếu nhất