Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

theo mình áp dụng định luật bảo toàn khối lượng ta có:
mX + mNaOH = mANCOL + m Muối
Nên mMuối= 9,34+0,13.(23+17) -4,6 =9,94 (g)
mình giải theo PƯ ban đàu thì:
nY=0,1 mol
nZ=0,015 mol
nhưng ko có ý nghĩa gì?

Chọn đáp án B
6,72 gam E cháy
→ B T K L C O 2 : 0 , 29 H 2 O : 0 , 18 → B T K L n C O O = 0 , 09 v à n N a O H = 0 , 11 → n X = n R C O O C 6 H 5 = 0 , 02 → n O H ( a n c o l ) = 0 , 07
Muối cháy

Đáp án B
Định hướng tư duy giải
6,72 gam E cháy → B T K L C O 2 : 0 , 29 H 2 O : 0 , 18 → B T K L n C O O = 0 , 09
Và ![]()
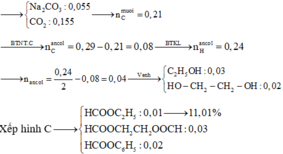
Muối cháy → N a 2 C O 3 : 0 , 055 C O 2 : 0 , 155 → n C ( m u o i ) = 0 , 21
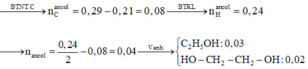
Xếp hình C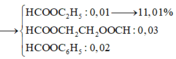

Giải thích:
nNa2CO3 = 0,5;nCO2 = 2,5mol
Nếu chỉ có muối RCOONa thì nRCOONa = 0,6mol ⇒ nNa2CO3 = 0,3mol < nRCOONa = 0,3mol đề bài ⇒ Loại
Vậy chứng tỏ trong Z có muối của phenol
2 muối bao gồm: RCOONa và R’ – C6H5ONa
⇒nRCOONa = 0,6mol; nR′−C6H5ONa = 0,4mol (bảo toàn Na)
Gọi số C trong muối axit và muối phenol lần lượt là a và b (b≥6)
Bảo toàn C: 0,6a + 0,4b = 0,5 + 2,5
⇒6a + 4b=30⇒3a+2b=15
Chỉ có b = 6 và a = 1 thỏa mãn.
⇒ HCOONa (0,6 mol) và C6H5ONa (0,4 mol)
Bảo toàn H: nH = 0,6 . 1 + 0,4 . 5 = 2,6
=> nH2O = 1,3 mol
=> m = 23,4g
Đáp án D

Chọn đáp án A
Đốt cháy 10,58g hỗn hợp X gồm 3 este đơn chức, mạch hở ta có: ![]() .
.
Mặt khác hidro hóa hoàn toàn 10,58 g hỗn hợp X cần 0,07 mol H2. Vậy 0,07 mol H2 chính là số mol liên kết π trong mạch Cacbon của 3 este.
![]()
Áp dụng định luật bảo toàn khối lượng cho phản ứng đốt cháy ta có:
![]()
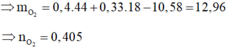
Áp dụng định luật bảo toàn nguyên tố O ta có:
![]()
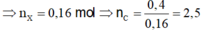
Vậy phải có 1 este có 2C. Vậy este đó phải là ![]() .
.
Theo đề bài ta thấy thủy phân Y trong NaOH chỉ thu được 1 ancol duy nhất, vậy ancol đó là CH3OH.
Vậy CT trung bình của 3 este sau khi hidro hóa là ![]() .
.
![]()
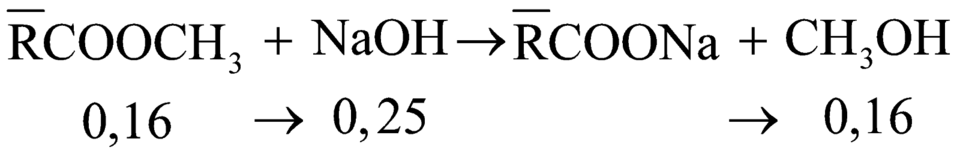
Áp dụng định luật bảo toàn khối lượng ta có:
![]()
![]()

Đáp án D
Bảo toàn nguyên tố Natri:
![]()
![]()
X chứa este của phenol.
Đặt ![]() của ancol = x;
của ancol = x; ![]() của phenol
của phenol
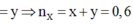 mol.
mol.
![]() mol.
mol.
Giải hệ có: x = 0,2 mol; y = 0,4 mol.
Do Z chỉ chứa 2 muối ⇒ Z gồm muối của axit cacboxylic và muối của phenol.
Đặt số C của muối của axit và phenol lần lượt là a và b (a ≥ 1; b ≥ 6).
.![]()
Giải phương trình nghiệm nguyên có a = 1; b = 6.
gồm 0,6 mol HCOONa và 0,4 mol C6H5ONa
(g).
![]() = 23,4 (g)
= 23,4 (g)
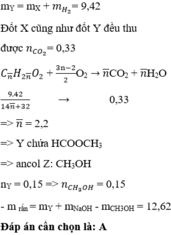

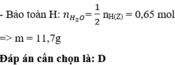

Gs: Este đơn chức Y : R1COOR2 và este no,hở Z : CxHyO2a
Bảo toàn KL cho pư cháy ta có mol(co2)=0,42 ,mol (h20)=0,31 →Este đơn chức ko no →mol Y=0,42-0,31=0,11.
btnt O2- tính đk : mol O2-(Y và z)=0,23mol ,Mà molY=0,11→mol (O2-trg Z)=0,23-0,11\(\times\)2=0,01mol
suy ra mol NaOH pư VỚi Y:0,11mol ,NaOH pư vs Z ;chắc chắn chỉ xảy ra 1 trong 2 TH:
TH1; este Z đơn chức →moL NaOH :0,01→tổng mol NaOH pư: 0,12mol→NaOH dư→muối khan =m(naoh dư)+m(muối)=9,94g
TH2;este Z 2 chức →mol NaOH ;0,02mol→tổng mol NaOH pư ;0,13mol→NaOHđủ→muối=9,94g