Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

Gọi số mol Mg, Fe, Al là a, b, c
=> 24a + 56b + 27c = 23,8
PTHH: Mg + 2HCl --> MgCl2 + H2
a------------------------->a
Fe + 2HCl --> FeCl2 + H2
b------------------------->b
2Al + 6HCl --> 2AlCl3 + 3H2
c------------------------->1,5c
=> a + b + 1,5c = \(\dfrac{17,92}{22,4}=0,8\left(mol\right)\)
PTHH: Mg + Cl2 --to--> MgCl2
a-->a
2Fe + 3Cl2 --to--> 2FeCl3
b--->1,5b
2Al + 3Cl2 --to--> 2AlCl3
c--->1,5c
=> \(a+1,5b+1,5c=\dfrac{20,16}{22,4}=0,9\left(mol\right)\)
=> a = 0,3; b = 0,2; c = 0,2
=> \(\left\{{}\begin{matrix}m_{Mg}=0,3.24=7,2\left(g\right)\\m_{Fe}=0,2.56=11,2\left(g\right)\\m_{Al}=0,2.27=5,4\left(g\right)\end{matrix}\right.\)

Giả sử: \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
_ Khi tác dụng với HCl.
Ta có: \(n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 3d = 0,45.2 ⇒ 2a + 2b + 3d = 0,9 (1)
_ Khi tác dụng với H2SO4 đặc nóng.
Ta có: \(n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\)
Theo ĐLBT mol e, có: 2a + 2b + 2c + 3d = 0,475.2
⇒ 2a + 2b - 2c + 3d = 0,95 (2)
Trừ 2 vế của (1) và (2), có: c = 0,025 (mol)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025.64}{14,7}.100\%\approx10,88\%\)
Bạn tham khảo nhé!
Đặt \(\left\{{}\begin{matrix}n_{Mg}=a\left(mol\right)\\n_{Zn}=b\left(mol\right)\\n_{Cu}=c\left(mol\right)\\n_{Al}=d\left(mol\right)\end{matrix}\right.\)
Ta có: \(\left\{{}\begin{matrix}n_{H_2}=\dfrac{10,08}{22,4}=0,45\left(mol\right)\\n_{SO_2}=\dfrac{10,64}{22,4}=0,475\left(mol\right)\end{matrix}\right.\)
Bảo toàn electron: \(\left\{{}\begin{matrix}2a+2b+2c+3d=0,475\cdot2\\2a+2b+3d=0,45\cdot2\end{matrix}\right.\)
\(\Rightarrow2c=0,475\cdot2-0,45\cdot2=0,05\) \(\Rightarrow c=0,025\)
\(\Rightarrow\%m_{Cu}=\dfrac{0,025\cdot64}{14,7}\cdot100\%\approx10,88\%\)

+ HCl và Cl2 đều đóng vai trò chất oxi hóa, mấu chốt của bài toán ta cần nhận ra được: Zn, Mg có hóa trị không đổi; Fe có nhiều hóa trị, cụ thể khi tác dụng với dung dịch thu được muối sắt (II), còn khi tác dụng với Cl2 thu được muối sắt (III).
+ Sử dụng công thức tính nhanh số mol Fe trong X:
![]()
![]()
![]()
Đáp án D

Đáp án D
Bảo toàn e:
+) X + HCl: 2nZn + 2nMg + 2nFe = 2nH2 = 1,0 mol
+) X + Cl2: 2nZn + 2nMg + 3nFe = 2nCl2 = 1,1 mol( khi phản ứng với Cl2, Fe thể hiện hóa trị 3)
⇒ nFe = 1,1 - 1,0 = 0,1 mol ⇒ mFe = 5,6 g


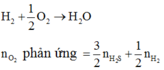
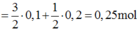

Quy đổi hỗn hợp gồm Al, Mg, Zn thành kim loại R (số oxi hóa +n)
Gọi số mol R là a (mol)
- Xét TN1:
\(n_{Cu}=\dfrac{3,2}{64}=0,05\left(mol\right)\)
- Xét TN2:
\(n_{Cl_2}=\dfrac{17,75}{71}=0,25\left(mol\right)\)
PTHH: Cu + Cl2 --to--> CuCl2
0,05->0,05
2R + nCl2 --to--> 2RCln
\(\dfrac{0,4}{n}\)<-0,2
=> \(n_R=\dfrac{0,4}{n}\left(mol\right)\)
- Xét TN1:
PTHH: 2R + 2nHCl --> 2RCln + nH2
\(\dfrac{0,4}{n}\)------------------->0,2
=> V = 0,2.22,4 = 4,48 (l)