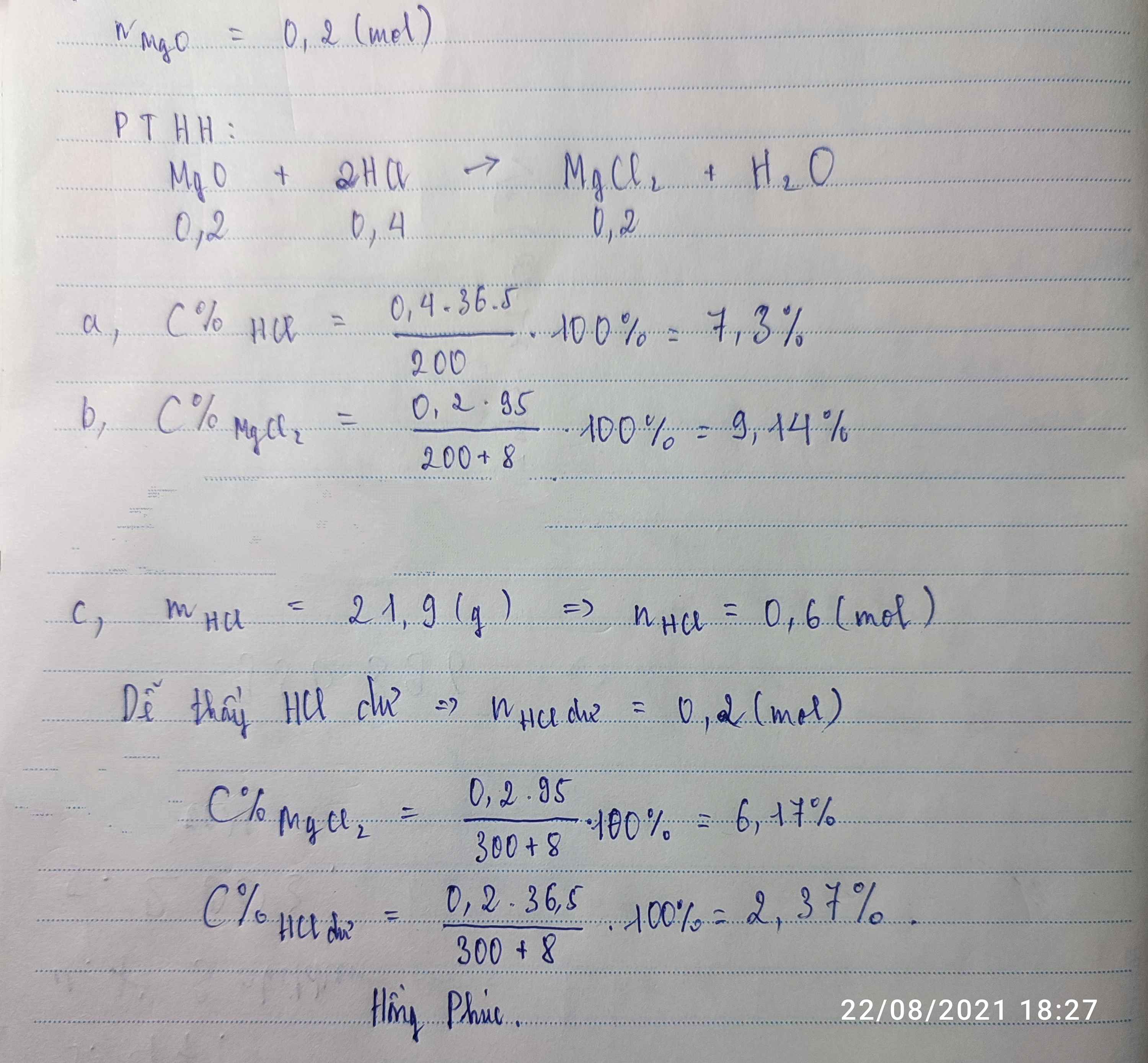Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Câu 4: Cho một mẩu nhôm vào ống nghiệm chứa dung dịch NaOH dư hiện tượng xuất hiện là:
A.Có khí không màu thoát ra, nhôm tan dần tạo thành dung dịch trong suốt
B.Có khí màu vàng lục thoát ra, nhôm tan dần tạo thành dung dịch trong suốt
C.Có khí không màu thoát ra, nhôm tan dần tạo thành dung dịch màu xanh
D.Không có khí thoát ra, nhôm tan dần tạo thành dung dịch trong suốt

Chọn C nha em!
PTHH: CuO + 2 HCl -> CuCl2 (dd màu xanh lam) + H2O

\(n_{FeO}=\dfrac{14,4}{72}=0,2\left(mol\right)\)
\(m_{ct}=\dfrac{10,95.200}{100}=21,9\left(g\right)\)
\(n_{HCl}=\dfrac{21,9}{36,5}=0,6\left(mol\right)\)
Pt : \(FeO+2HCl\rightarrow FeCl_2+H_2O|\)
1 2 1 1
0,2 0,6 0,2
a) Lập tỉ số so sánh : \(\dfrac{0,2}{1}< \dfrac{0,6}{2}\)
⇒ FeO phản ứng hết , HCl dư
⇒ Tính toán dựa vào số mol của FeO
\(n_{HCl\left(dư\right)}=0,6-\left(0,2.2\right)=0,2\left(mol\right)\)
⇒ \(m_{HCl\left(dư\right)}=0,2.36,5=7,3\left(g\right)\)
b) \(n_{FeCl2}=\dfrac{0,2.1}{1}=0,2\left(mol\right)\)
⇒ \(m_{FeCl2}=0,2.127=25,4\left(g\right)\)
\(m_{ddspu}=14,4+200=214,4\left(g\right)\)
\(C_{FeCl2}=\dfrac{25,4.100}{214,4}=11,85\)0/0
\(C_{HCl\left(dư\right)}=\dfrac{7,3.100}{214,4}=3,4\)0/0
Chúc bạn học tốt

\(2NaOH + H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O\)
\(m_{NaOH}= 20 .10\)%=2g \(\Rightarrow n_{NaOH}=\dfrac{2}{40}=0,05 mol\)
mH2SO4= 20 . 10% = 2g \(\Rightarrow n_{H_2SO_4}= \dfrac{2}{98}= 0,02 mol\)
\(2NaOH + H_2SO_4 \rightarrow Na_2SO_4 + 2H_2O\)
Trước pư: 0,05 0,02
PƯ: 0,04 0,02 0,02
Sau pư: 0,01 0 0,02
dd sau pư gồm NaOH dư và Na2SO4
\(m_{dd sau pư}= m_{NaOH} + m_{H_2SO_4}= 20 + 20=40g\)
Ta có
C%\(NaOH\)=\(\dfrac{0,01 . 40}{40} . 100\)%=1%
C%\(Na_2SO_4\)=\(\dfrac{0,02 .142}{40} . 100\)%=7,1%

a) $n_{H_2SO_4} = 0,1.4,8 = 0,48(mol)$
$Al_2O_3 + 3H_2SO_4 \to Al_2(SO_4)_3 + 3H_2O$
$n_{Al_2O_3} = \dfrac{1}{3}n_{H_2SO_4} =0,16(mol)$
$m = 0,16.102 = 16,32(gam)$
b)
$n_{Al_2(SO_4)_3} = n_{Al_2O_3} = 0,16(mol)$
$m_{muối} = 0,16.342 = 54,72(gam)$
c)
$Al_2O_3 + 2KOH \to 2KAlO_2 + H_2O$
$n_{KOH} = 2n_{Al_2O_3} = 0,32(mol)$
$V_{dd\ KOH} = \dfrac{0,32}{4,8} = 0,067(lít)$
Ta có: \(n_{H_2SO_4}=0,1.4,8=0,48\left(mol\right)\)
PT: \(Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\)
___0,16_____0,48______0,16 (mol)
a, m = mAl2O3 = 0,16.102 = 16,32 (g)
b, mAl2(SO4)3 = 0,16.342 = 54,72 (g)
c, \(Al_2O_3+2KOH\rightarrow2KAlO_2+H_2O\)
____0,16____0,32 (mol)
\(\Rightarrow V_{ddKOH}=\dfrac{0,32}{4,8}=\dfrac{1}{15}\left(l\right)\)
Bạn tham khảo nhé!

Phương trình hóa học của phản ứng:
Fe + 2HCl → Fe Cl 2 + H 2
Fe + H 2 SO 4 → FeSO 4 + H 2
Qua các phương trình hóa học trên và dữ liệu đề bài, ta có:
n FeCl 2 = 19,05/127 = 0,15 mol = n Fe
m FeSO 4 = 0,15 x 152 = 22,8g