Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

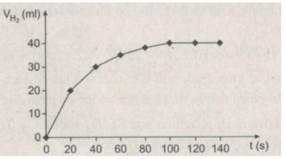
Từ 0 giây đến 20 giây là đoạn đồ thị dốc nhất, đó là khoảng thời gian phản ứng có tốc độ cao nhất.
Ở thời điểm phản ứng kết thúc, đồ thị nằm ngang, thể tích hiđro thu được là cực đại 40 ml. Tại thời điểm đó axit clohiđric đã phản ứng hết.

Thể tích khí hiđro :
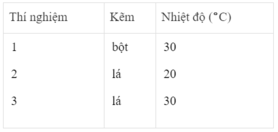
Sau các thí nghiệm, kẽm còn dư. Như vậy, thể tích khí hiđro được sinh ra phụ thuộc vào lượng H 2 SO 4 tham gia phản ứng
n H 2 = n H 2 SO 4 = 2.50/1000 = 0,1 mol
Thể tích khí hiđro ở điều kiện phòng là :
V H 2 = 0,1 x 24 = 2,4l = 2400 cm 3
Ta ghi số 2400 cm 3 trên trục y, nơi giao điểm giữa trục y và đường ngang của 3 đường cong kéo dài (nét chấm trên đồ thị).

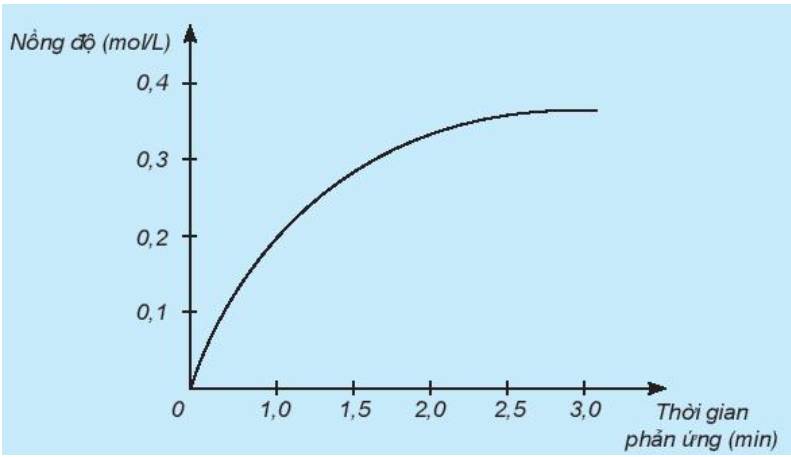
a) Theo thời gian, nồng độ có xu hướng tăng dần
=> Đồ thị mô tả sự thay đổi nồng độ theo thời gian của sản phẩm HCl
b) Đơn vị của tốc độ phản ứng trong trường hợp này là phút (min).

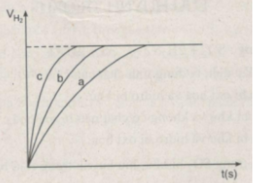
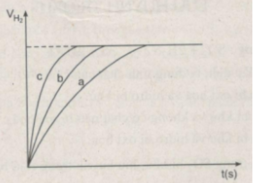
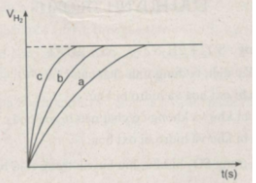
Đồ thị biểu diễn các phản ứng :
Đường cong c biểu diễn cho thí nghiệm 1, phản ứng xảy ra nhanh nhất
Đường cong b biểu diễn cho thí nghiệm 3, phản ứng xảy ra nhanh trung bình.
Đường cong a biểu diễn cho thí nghiệm 2, phản ứng xảy ra chậm nhất.

\(n_{Mg}=\dfrac{4,8}{24}=0,2\left(mol\right)\\ a.Mg+2HCl\rightarrow MgCl_2+H_2\\ n_{H_2}=n_{MgCl_2}=n_{Mg}=0,2\left(mol\right)\\ V_{H_2\left(đktc\right)}=0,2.22,4=4,48\left(l\right)\\ b.n_{HCl}=0,2.2=0,4\left(mol\right)\\ m_{ddHCl}=\dfrac{0,4.36,5.100}{7,3}=200\left(g\right)\\ c.m_{ddsau}=4,8+200-0,2.2=204,4\left(g\right)\\ C\%_{ddMgCl_2}=\dfrac{0,2.95}{204,4}.100\approx9,295\%\\ d.V_{ddHCl}=\dfrac{200}{1,05}=\dfrac{4000}{21}\left(ml\right)=\dfrac{4}{21}\left(l\right)\\ C_{MddHCl}=\dfrac{0,4}{\dfrac{4}{21}}=2,1\left(M\right)\)

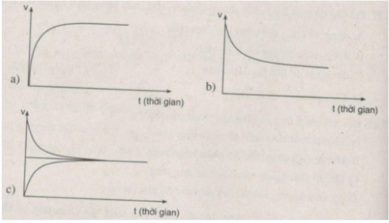
Đồ thị a biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian.
Đồ thị b biểu diễn sự biến đổi tốc độ phản ứng nghịch theo thời gian.
Đồ thị c biểu diễn trạng thái cân bằng hoá học.

Nhận xét:
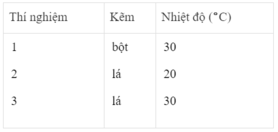
- Khí hiđro được giải phóng ở thí nghiệm 1 nhiều, nhanh hơn ở thí nghiệm 3. Vì diện tích tiếp xúc của Zn với H 2 SO 4 ở thí nghiệm 1 lớn hơn. trong khi đó nhiệt độ của dung dịch axit là như nhau.
- Khí hiđro được giải phóng ở thí nghiệm 3 nhiều, nhanh hơn ở thí nghiệm 2. Vì nhiệt độ của dung dịch H 2 SO 4 ở thí nghiệm 3 cao hơn, trong khi đó diện tích tiếp xúc giữa Zn và axit là như nhau.

số mol kẽm tham gia phản ứng là:\(n_{Zn}=\frac{m}{M}=\frac{6,5}{65}=0,1\left(mol\right)\)
PTHH:
\(Zn+2HCl\rightarrow ZnCl_2+H_2\)
0,1 0,2 0,1 (mol)
a, thể tích khí hiđro thu được là:\(V_{H_2}=n_{H_2}\times22,4=0,1\times22,4=2,24\left(l\right)\)
b,khối lượng HCl cần dùng là:\(m_{HCl}=n_{HCl}\times M=0,2\times65=13\left(g\right)\)
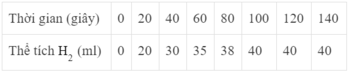
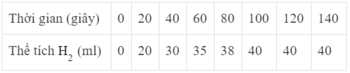
 a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?
a) Đồ thị này mô tả sự thay đổi nồng độ theo thời gian của chất nào?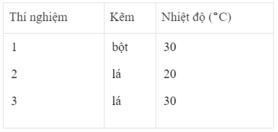
 Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là:
Biến thiên nồng độ trong khoảng thời gian từ 0 giờ đến 3 giờ là: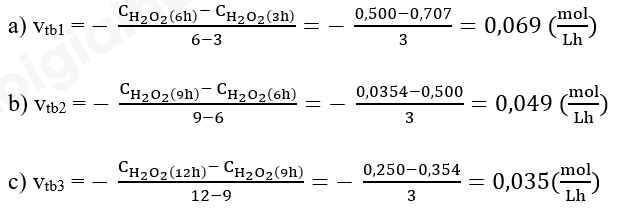
Dạng đồ thị biểu diễn sự phụ thuộc của nồng độ axit HCL theo thời gian