Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C.
Kim loại không phản ứng với H2SO4 loãng là Cu.
Gọi nCu = x, nMg = y, nAl = z
Ta có:
64x + 24y + 27z = 33,2 (1)
Bảo toàn e:
2nMg + 3nAl = 2nH2
=> 2y + 3z = 2.1 (2)
2nCu = 2nSO2 => x = 0.2 (mol) (3)
Từ 1, 2, 3 => x = 0,2; y = z = 0,4 (mol)
mCu = 0,2.64 = 12,8 (g)
mMg = 0,4.24 = 9,6 (g)
mAl = 10,8 (g)

\(n_{SO_2}=0.2\left(mol\right)\)
Bảo toàn e :
\(n_{Cu}=n_{SO_2}=0.2\left(mol\right)\)
\(m_{Cu}=0.2\cdot64=12.8\left(g\right)\)
\(m_{Mg}+m_{Al}=24x+27y=33.2-12.8=20.4\left(g\right)\left(1\right)\)
\(n_{H_2}=x+1.5y=1\left(mol\right)\left(2\right)\)
\(\left(1\right),\left(2\right):x=y=0.4\)
\(m_{Mg}=0.4\cdot24=9.6\left(g\right)\)
\(m_{Al}=10.8\left(g\right)\)
=> C

Đáp án D
Gọi M là kim loại chung cho Mg, Fe và Al với hóa trị n
Gọi số mol H2 thu được là a mol
Sơ đồ phản ứng :
![]()
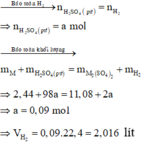

Ta có: \(m_{H_2}=\dfrac{4,48}{22,4}=0,2\left(mol\right)\) \(\Rightarrow m_{H_2}=0,2\cdot2=0,4\left(g\right)\)
\(\Rightarrow m_{dd\left(sau.pư\right)}=m_{hh}+m_{ddH_2SO_4}-m_{H_2}=309,6\left(g\right)\)
\(\Rightarrow a=309,6-300=9,6\left(g\right)\)

Bài 1.
Gọi \(x,y,z\) lần lượt là số mol của \(Mg,Fe\left(OH\right)_2,CuO\) có trong hỗn hợp X.
\(m_X=24x+90y+80z=66,4\left(g\right)\left(1\right)\)
Phần 1: \(n_{H_2SO_4}=\frac{x}{2}+\frac{y}{2}+\frac{z}{2}=0,6\left(mol\right)\left(2\right)\)
Phần 2: Áp dụng công thức PV = RnT cho lượng khí \(SO_2\) sinh ra.
Ta có: \(2.4,92=\frac{22,4}{273}.n_{SO_2}.\left(27+273\right)\Leftrightarrow n_{SO_2}=0,4\left(mol\right)\)
\(Mg^0\rightarrow Mg^{+2}+2e\)
\(\frac{x}{2}------>x\)
\(Fe^{+2}\rightarrow Fe^{+3}+e\)
\(\frac{y}{2}----->\frac{y}{2}\)
\(S^{+6}+2e\rightarrow S^{+4}\)
\(0,8->0,4\)
\(\Rightarrow n\)e trao đổi\(=2.0,4=0,8\left(mol\right)\)
\(\Leftrightarrow x+\frac{y}{2}=0,8\left(mol\right)\left(3\right)\)
Từ (1), (2), (3); ta có hệ: \(\left\{{}\begin{matrix}24x+90y+80z=66,4\\\frac{x}{2}+\frac{y}{2}+\frac{z}{2}=0,6\\x+\frac{y}{2}=0,8\end{matrix}\right.\Leftrightarrow\left\{{}\begin{matrix}x=0,6\\y=0,4\\z=0,2\end{matrix}\right.\)
\(\Rightarrow m_{Mg}=0,6.24=14,4\left(g\right);m_{Fe\left(OH\right)_2}=0,4.90=36\left(g\right);m_{CuO}=0,2.80=16\left(g\right)\)

Thể tích dung dịch H 2 SO 4 tham gia phản ứng :
Số mol H 2 SO 4 tham gia (1) và (2) là :
0,1 + 0,3 = 0,4 (mol)
Thể tích dung dịch H 2 SO 4 là :
V H 2 SO 4 = 0,4/2 = 0,2 l




3.
\(n_{H_2}=\frac{5,6}{22,4}=0,25\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
x mol-------------------------> \(\frac{3}{2}x\) mol
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
y mol-------------------------> y mol
Ta có hệ pt: \(\left\{\begin{matrix}27x+24y=5,1\\\frac{3}{2}x+y=0,25\end{matrix}\right.\) \(\Leftrightarrow\left\{\begin{matrix}x=0,1\\y=0,1\end{matrix}\right.\)
\(\Rightarrow m_{Al}=0,1\times27=2,7g\)
\(\Rightarrow\%m_{Al}=\frac{2,7}{5,1}.100=52,9\%\)
\(\Rightarrow\%m_{Mg}=100\%-52,9\%=47,1\%\)
1) Fe + H2SO4 --> FeSO4 + H2
0,1 -------------------> 0,1 (mol)
n Fe = 5,6 / 56 = 0,1 (mol)
10FeSO4 + 8H2SO4 + 2KMnO4 -> 5Fe2(SO4)3 + 2MnSO4 + 8H2O +K2SO4
0,1 --------------------------> 0,02(mol)
=> CM = n / V => V = n / CM = 0,02 / 0,5 = 0,04 (lit)