Cho 50 ml dung dịch HCl 0,2 M phản ứng hoàn toàn với NaOH 0,1 M. Tính thể tích dung dịch NaOH cần thiết để trung hòa hết lượng HCl trong dung dịch.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(\left\{{}\begin{matrix}n_{HCl}=0,1.1=0,1\left(mol\right)\\n_{H_2SO_4}=0,1.1=0,1\left(mol\right)\end{matrix}\right.\)
PTHH:
\(NaOH+HCl\rightarrow NaCl+H_2O\)
0,1<------0,1
\(2NaOH+H_2SO_4\rightarrow Na_2SO_4+2H_2O\)
0,2<--------0,1
\(\Rightarrow V_{ddNaOH}=\dfrac{0,2+0,1}{1}=0,3\left(l\right)\)

Đáp án A
Thí nghiệm 1 có nOH-= nH+
Nên 30.2= 20.C1+ 20.C2+ 30.1
Thí nghiệm 2 có nOH-= nH+
Nên 10.C1+ 20.C2 = 1.20
Suy ra C1 = 1,0 và C2 = 0,5

\(n_{HCl}=0,1.1=0,1\left(mol\right);n_{H_2SO_4}=0,1.1=0,1\left(mol\right)\)
PTHH:
`NaOH + HCl -> NaCl + H_2O`
`2NaOH + H_2SO_4 -> Na_2SO_4 + 2H_2O`
Theo PT: `n_{NaOH} = 2n_{H_2SO_4} + n_{HCl} = 0,3 (mol)`
`=> V_{ddNaOH} = (0,3)/(1) = 0,3(l)`

Gọi thể tích NaOH cần dùng là V(l)
=> nNaOH = 0,5V (mol)
nHCl = 0,2.0,1=0,02(mol); nH2SO4 = 0,1.0,1=0,01(mol
PTHH: NaOH + HCl --> NaCl + H2O
_____0,02<---0,02
2NaOH + H2SO4 --> Na2SO4 + 2H2O
_0,02<---0,01
=> 0,5V = 0,04
=> V = 0,08 (l)

\(n_{NaOH}=0.15\cdot1=0.15\left(mol\right)\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(0.15...........0.15\)
\(V_{dd_{HCl}}=\dfrac{0.15}{0.5}=0.3\left(l\right)\)
\(C\)

Trong 100 ml thì :
\(n_{H^+}=0.1\cdot\left(0.015\cdot2+0.03+0.04\right)=0.01\left(mol\right)\)
Trong 200 ml :
\(n_{H^+}=0.01\cdot2=0.02\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
\(0.02.......0.02\)
\(V_{dd_{NaOH}}=\dfrac{0.02}{0.2}=0.1\left(l\right)\)

nH2=\(\frac{6,72}{22,4}=0,3\)mol
PTHH
M+2HCl--> MCl2+H2
0,3mol<---------------0,3mol
=>MM=\(\frac{19,5}{0,3}=64\)
=> km loại là kẽm (Zn)
b) nNaOH=0,2.1=0,2 mol
PTHH
NaOH+HCl-->NaCl + H2O
0,2 mol--> 0,2 mol
---> thể tích HCl 1M đã dùng là V=\(\frac{0,2+0,3}{1}=0,5\)lít
=> CM(ZnCl2)=\(\frac{0,3}{0,5}=0,6M\)
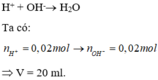
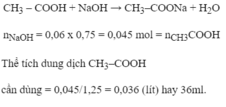
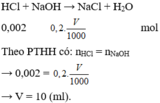
\(NaOH+HCl\rightarrow NaCl+H_2O\)
0,01 0,01 0,01 0,01
số mol dung dịch HCl là:
\(C_M=\dfrac{n_{HCl}}{V_{HCl}}⇒\:n_{HCl}=C_M\cdot V_{HCl}=0,2\cdot0,05=0,01\left(mol\right)\)
thể tích NaOH cần thiết để trung hoà là:
\(C_{M_{NaOH}}=\dfrac{n_{NaOH}}{V_{NaOH}}⇒\:V_{NaOH}=\dfrac{n_{NaOH}}{C_{M_{NaOH}}}=\dfrac{0,01}{0,1}=0,1\left(L\right)\)
Giải bài toán:
Dữ kiện:
\(\text{HCl} + \text{NaOH} \rightarrow \text{NaCl} + \text{H}_{2} \text{O}\).
Bước 1: Tính số mol HCl
Số mol HCl được tính theo công thức:
\(n \left(\right. \text{HCl} \left.\right) = C \times V = 0 , 2 \textrm{ } \text{mol}/\text{l} \times 0 , 05 \textrm{ } \text{l} = 0 , 01 \textrm{ } \text{mol} .\)Bước 2: Tính số mol NaOH cần thiết
Theo phương trình phản ứng, \(n \left(\right. \text{NaOH} \left.\right) = n \left(\right. \text{HCl} \left.\right)\), vì tỉ lệ mol là 1:1.
\(n \left(\right. \text{NaOH} \left.\right) = 0 , 01 \textrm{ } \text{mol} .\)Bước 3: Tính thể tích dung dịch NaOH
Thể tích dung dịch NaOH được tính theo công thức:
\(V \left(\right. \text{NaOH} \left.\right) = \frac{n \left(\right. \text{NaOH} \left.\right)}{C \left(\right. \text{NaOH} \left.\right)} = \frac{0 , 01 \textrm{ } \text{mol}}{0 , 1 \textrm{ } \text{mol}/\text{l}} = 0 , 1 \textrm{ } \text{l} = 100 \textrm{ } \text{ml} .\)Đáp số:
Thể tích dung dịch NaOH cần thiết để trung hòa hết lượng HCl là 100 ml.