Cho phản ứng của các chất ở thể khí:
\(2NOCl\left(g\right)\rarr2NO\left(g\right)+Cl_2\left(g\right)\)
Hãy viết biểu thức tính tốc độ trung bình theo sự biến đổi nồng độ chất đầu và chất sản phẩm của phản ứng trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Áp suất tăng 3 lần, nhiệt độ không đổi thì thể tích giảm 3 lần nên nồng độ tăng 3 lần
Vậy tốc độ phản ứng tăng: 3.3.3 = 27 (lần)

- Xét biểu thức
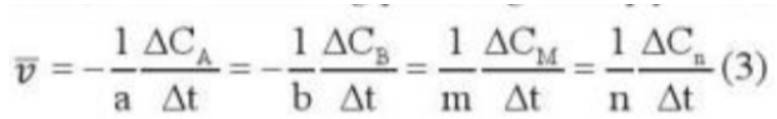
- Sau thời gian phản ứng, nồng độ chất tham gia giảm
=> Csau < Ctrước
=> ∆C < 0
- Trong khi đó: ∆t = tsau - ttrước
=> ∆t > 0
=> Phải thêm dấu trừ trong biểu thức (3) đối với chất tham gia phản ứng để tốc độ phản ứng có giá trị dương

a) Tốc độ trung bình (mol/s) của phản ứng (1):
\(\overline{\upsilon}=\dfrac{2}{95.60}=\dfrac{1}{2850}=3,5.10^{-4}\)
b) Tốc độ trung bình của phản ứng (2) tương đương (1), khối lượng NaCl:
\(\dfrac{2.58,5}{95}\approx1,23\left(g\right)\)

Gọi ∆CNO, ∆CH2, ∆CN2, ∆CH2O lần lượt là biến thiên nồng độ các chất NO, H2, N2 và H2O trong khoảng thời gian . Tốc độ trung bình của phản ứng được tính theo biểu thức: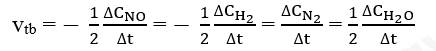

a) Công thức tính tốc độ tức thời của phản ứng là: v1 = k.CNO2.CO2
b)
- Nồng độ O2 tăng 3 lần, nồng độ NO không đổi: v2 = k.CNO2.(CO2.3)
=> v2 tăng 3 lần so với v1
- Nồng độ NO tăng 3 lần, nồng độ O2 không đổi: v3 = k.(CNO.3)2.CO2 = k.CNO2.9.CO2
=> v3 tăng 9 lần so với v1
- Nồng độ NO và O2 đều tăng 3 lần: v4 = k.(CNO.3)2.(CO2.3) = k.CNO2.27.CO2
=> v4 tăng 27 lần so với v1

Tốc độ phản ứng tăng 8 lần nếu nồng độ cả 2 chất tăng lên 2 lần là thỏa mãn
A thì tốc độ phản ứng tăng 16 lần
C thì tốc độ phản ứng tăng 4 lần
D thì tốc độ phản ứng tăng 32 lần
Vậy chọn B
Phản ứng: 2NOCl(g) -> 2NO(g) + Cl2(g)
Biểu thức tính tốc độ trung bình (vtb):
vtb = - (1/2) * (Δ[NOCl] / Δt) = - (1/2) * ([NOCl]t2 - [NOCl]t1 / (t2 - t1))
vtb = + (1/2) * (Δ[NO] / Δt) = + (1/2) * ([NO]t2 - [NO]t1 / (t2 - t1))
vtb = + (1/1) * (Δ[Cl2] / Δt) = + (Δ[Cl2] / Δt) = + ([Cl2]t2 - [Cl2]t1 / (t2 - t1))
Tổng hợp lại, biểu thức đầy đủ là:
vtb = - (1/2) * (Δ[NOCl] / Δt) = + (1/2) * (Δ[NO] / Δt) = + (Δ[Cl2] / Δt)
Trong đó: