2. Cho 200 ml dung dịch CH₃COOH 2M tác dụng hết với Zn thấy thoát ra khí. a, Tính thể tích khí thoát ra ở điều kiện tiêu chuẩn (đktc). b, Tính khối lượng kim loại Zn đã dùng.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Câu 4:
a, \(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PT: \(Zn+2CH_3COOH\rightarrow\left(CH_3COO\right)_2Zn+H_2\)
Theo PT: \(n_{CH_3COOH}=2n_{H_2}=0,5\left(mol\right)\Rightarrow V_{CH_3COOH}=\dfrac{0,5}{2,5}=0,2\left(l\right)\)
b, \(n_{\left(CH_3COO\right)_2Zn}=n_{H_2}=0,25\left(mol\right)\)
\(\Rightarrow m_{\left(CH_3COO\right)_2Zn}=0,25.183=45,75\left(g\right)\)

- Axit acrylic ( CH 2 = CH − COOH ) không tham gia phản ứng với NaNO 3 .
- Chọn đáp án A.

2CH2=CH-COOH + Na2CO3 → 2CH2=CH-COONa + CO2 + H2O
CH2=CH-COOH + NaOH → CH2=CH-COONa + ½ H2
CH2=CH-COOH + → CH 2 Br -CHBr-COOH
Chọn C.

2CH2=CH-COOH + Na2CO3 → 2CH2=CH-COONa + CO2 + H2O
CH2=CH-COOH + NaOH → CH2=CH-COONa + ½ H2
CH2=CH-COOH + Br2 → CH2Br-CHBr-COOH
=> Chọn C

Đáp án D
Axit crylic yếu hơn axit HNO3 nên nó không phản ứng được với muối của axit này
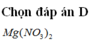
\(2CH_3COOH+Zn\rightarrow\left(CH_3COO\right)_2Zn+H_2\)
0,4 0,2 0,2 0,2
số mol \(CH_3COOH\) là:
\(n_{CH_3COOH}=C_M\cdot V=2\cdot0,2=0,4\left(mol\right)\)
a; thể tích khí thoát ra là:
\(V=22,4\cdot n=22,4\cdot0,2=4,48\left(L\right)\)
b; khối lượng kim loại Zn đã dùng là:
\(m_{Zn}=n_{Zn}\cdot M_{Zn}=0,2\cdot65=13\left(g\right)\)