cho 10,2 gam Al2 O3 tác dụng hết với HCL Viết phương trình phản ứng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(a)BaCO_3+2HCl\rightarrow BaCl_2+CO_2+H_2O\\ b)Fe_2\left(SO_4\right)_3+6NaOH\rightarrow2Fe\left(OH\right)_3+3Na_2SO_4\\ c)Al_2O_3+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2O\\ d)2Al+6HCl\rightarrow2AlCl_3+3H_2\\ e)P_2O_5+3Ba\left(OH\right)_2\rightarrow Ba_3\left(PO_4\right)_2+3H_2O\\ f)SO_3+2KOH\rightarrow K_2SO_4+H_2O\\ g)Ba\left(NO_3\right)_2+Na_2SO_4\rightarrow BaSO_4+2NaNO_3\\ h)FeO+2HCl\rightarrow FeCl_2+H_2O\\ i)3CaCl_2+2Na_3PO_4\rightarrow Ca_3\left(PO_4\right)_2+6NaCl\\ j)Mg+2HCl\rightarrow MgCl_2+H_2\\ k)Zn+H_2SO_4\rightarrow ZnSO_4+H_2\\ l)NaOH+HCl\rightarrow NaCl+H_2O\\ m)KCl+AgNO_3\rightarrow AgCl+KNO_3\\ CO_2+Ba\left(OH\right)_2\rightarrow BaCO_3+H_2O\)

a)
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O$
b)
n HCl = 0,4.1,5 = 0,6(mol)
n Al2O3 = 1/6 n HCl = 0,1(mol) => m = 0,1.102 = 10,2(gam)
n AlCl3 = 1/3 n HCl = 0,2(mol) => CM AlCl3 = 0,2/0,4 = 0,5M

a)
$6NaOH + P_2O_5 \to 2Na_3PO_4 + 3H_2O$
b)
$2KOH + H_2SO_4 \to K_2SO_4 + 2H_2O$
c)
Không phản ứng
d)
$Al_2O_3 + 6HCl \to 2AlCl_3 + 3H_2O$
e)
$Cu(OH)_2 + 2HNO_3 \to Cu(NO_3)_2 + 2H_2O$
f)
$CO_2 + Ca(OH)_2 \to CaCO_3 + H_2O$
g) Không phản ứng
$h) Al(OH)_3 + 3HCl \to AlCl_3 + 3H_2O$
$i) SO_2 + 2NaOH \to Na_2SO_3 + H_2O$
a) Không tồn tại vì
$NaOH + HBr \to NaBr + H_2O$
b) Không tồn tại vì
$BaCl_2 + H_2SO_4 \to BaSO_4 + 2HCl$
c) Không tồn tại vì
$Ca(OH)_2 + H_2SO_4 \to CaSO_4 + 2H_2O$
d) Không tồn tại vì
$HCl + AgNO_3 \to AgCl + HNO_3$
e) Tồn tại
f) Không tồn tại vì
$NaCl + AgNO_3 \to AgCl + NaNO_3$
g) Không tồn tại vì
$Na_2CO_3 + 2HCl \to 2NaCl + CO_2 + H_2O$
h) Tồn tại
i) Không tồn tại vì
$K_2SO_3 + H_2SO_4 \to K_2SO_4 + SO_2 + H_2O$

a, 4Na + O2 \(\rightarrow\) 2Na2O
Số nguyên tử Na : Số phân tử O : Số phân tử Na2O = 4 : 1 : 2
b, 2Fe + 3Cl2 \(\rightarrow\) 2FeCl3
Số nguyên tử Fe : Số phân tử Cl2 : Số phân tử FeCl3 = 2 : 3 : 2
c, Al2O3 + 6HCl \(\rightarrow\) 2AlCl3 + 3H2O
Số phân tử Al2O3 : số phân tử HCl : Số phân tử AlCl3 : Số phân tử H2O = 1 : 6 : 2 :3

\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
\(2Na+2HCl\rightarrow2NaCl+H_2O\)
\(Mg+2HCl\rightarrow MgCl_2+H_2\)
\(NaOH+HCl\rightarrow NaCl+H_2O\)
\(Cu\left(OH\right)_2+2HCl\rightarrow CuCl_2+2H_2O\)
\(Al\left(OH\right)_3+3HCl\rightarrow AlCl_3+3H_2O\)
\(Al_2O_3+6HCl\rightarrow2AlCl_3+3H_2O\)
\(FeO+2HCl\rightarrow FeCl_2+H_2O\)
\(Fe_2O_3+6HCl\rightarrow2FeCl_3+3H_2O\)
\(CaCO_3+2HCl\rightarrow CaCl_2+CO_2+H_2O\)
\(Na_2SO_3+2HCl\rightarrow2NaCl+SO_2+H_2O\)
\(K_2CO_3+2HCl\rightarrow2KCl+CO_2+H_2O\)
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)

\(a.2Ca+O_2\overset{t^o}{--->}2CaO\)
\(b.Fe+2HCl--->FeCl_2+H_2\)
\(c.4Al+3O_2\overset{t^o}{--->}2Al_2O_3\)
\(d.Al_2O_3+3H_2SO_4--->Al_2\left(SO_4\right)_3+3H_2O\)
\(e.2Fe\left(OH\right)_3\overset{t^o}{--->}Fe_2O_3+3H_2O\)
\(f.N_2+3H_2\overset{t^o}{--->}2NH_3\)
\(g.2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\)

a)
2NaOH + H2SO4 --> Na2SO4 + 2H2O
6NaOH + P2O5 --> 2Na3PO4 + 3H2O
2NaOH + CO2 --> Na2CO3 + H2O
2NaOH + MgCl2 --> Mg(OH)2\(\downarrow\) + 2NaCl
2NaOH + Al2O3 --> 2NaAlO2 + H2O
2NaOH + SiO2 -to-> Na2SiO3 + H2O
b)
Fe(OH)2 + H2SO4 --> FeSO4 + 2H2O
Fe(OH)2 + 2HCl --> FeCl2 + 2H2O
a, 2NaOH + H2SO4 -> Na2SO4 + 2H2O
P2O5 + 6NaOH -> 2Na3PO4 + 3H2O
2NaOH + CO2 -> Na2CO3 + H2O
2NaOH + MgCl2 -> 2NaCl + Mg(OH)2
2NaOH + BaCl2 -> Ba(OH)2 + 2NaCl
Al2O3 + 2NaOH -> (t°) 2NaAlO2 + H2O
SiO2 + 2NaOH -> Na2SiO3 + H2O
MgCO3 + 2NaOH -> Mg(OH)2 + Na2CO3
b, Fe(OH)2 + H2SO4 -> FeSO4 + 2H2O
Fe(OH)2 + 2HCl -> FeCl2 + H2O
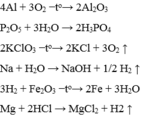
Al2O3+6HCl→2AlCl3+3H2O