đốt 9,2g Na trong bình chứa 4958 mL O2 (đkt) biết phản ứng xảy ra theo sơ đồ: Na+O2 -->Na2O
a,Sau phản ứng chất nào dư? dư bao nhiêu?
b, tính số khối lượng sản phẩm thu đc?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Bài 1. Đốt cháy hoàn toàn 10,35 gam kim loại Na, phản ứng xảy ra theo sơ đồ sau: Na + O2 -----> Na2O
a) Tính khối lượng Na2O tạo thành sau phản ứng.
b) Tính thể tích khí O2 (đktc) đã phản ứng.
----
a) 4 Na + O2 -to-> 2 Na2O
Ta có: nNa=10,35/23=0,45(mol)
=> nNa2O=0,45/2=0,225(mol)
=>mNa2O=0,225.62=13,95(g)
b) nO2= 0,45/4= 0,1125(mol)
=>V(O2,đktc)=0,1125.22,4=2,52(l)
Bài 2. Nhôm tác dụng với axit H2SO4 theo sơ đồ phản ứng sau:
Al + H2SO4 -----> Al2(SO4)3 + H2
Biết thể tích khí H2 thu được sau phản ứng là 3,36 lít (đktc).
a) Tính khối lượng Al và H2SO4 đã tham gia phản ứng.
b) Tính khối lượng Al2(SO4)3 sinh ra sau phản ứng.
---
a) nH2=3,36/22,4=0,15(mol)
PTHH: 2Al +3 H2SO4 -> Al2(SO4)3 + 3 H2
0,1______0,15_____0,05______0,15(mol)
mAl=0,1.27=2,7(g)
mH2SO4=0,15.98=14,7(g)
b) mAl2(SO4)3=342.0,05=17,1(g)

\(n_{Na}=\dfrac{4,6}{23}=0,2\left(mol\right)\)
PT: \(4Na+O_2\underrightarrow{t^o}2Na_2O\)
Theo PT: \(n_{Na_2O\left(LT\right)}=\dfrac{1}{2}n_{Na}=0,1\left(mol\right)\)
\(\Rightarrow m_{Na_2O\left(LT\right)}=0,1.62=6,2\left(g\right)\)
\(\Rightarrow H=\dfrac{4,96}{6,2}.100\%=80\%\)

mO2 = 0,3 × 32 = 9.6g
Áp dụng DLBTKL ta có mNa + mO2 = mNa2o=> mNa2O = mNa + mO2 = 4,6 + 9,6 = 14,2 g
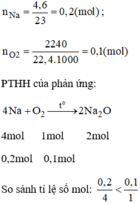
Vậy O 2 dư.
Sau phản ứng Na không dư nên không có khí H 2 bay ra, quỳ tím chuyển sang màu xanh vì:
N a 2 O + H 2 O → 2 N a O H

\(n_{Na}=\dfrac{4.6}{23}=0.2\left(mol\right)\)
\(n_{O_2}=\dfrac{0.448}{22.4}=0.02\left(mol\right)\)
\(4Na+O_2\underrightarrow{^{^{t^0}}}2Na_2O\)
\(4..........1\)
\(0.2.....0.02\)
\(LTL:\dfrac{0.2}{4}>\dfrac{0.02}{1}\Rightarrow Nadư\)
\(m_{Na\left(dư\right)}=\left(0.2-0.08\right)\cdot23=2.76\left(g\right)\)
\(m_{Na_2O}=0.04\cdot62=2.48\left(g\right)\)

\(n_{O_2}=\dfrac{V_{O_2\left(đktc\right)}}{22,4}=\dfrac{1,68}{22,4}=0,075\left(mol\right)\\ \Rightarrow m_{O_2}=n_{O_2}.M_{O_2}=0,075.32=2,4\left(g\right)\\ PTHH:4Na+O_2\rightarrow Na_2O\\ 2Ca+O_2\rightarrow\left(t^o\right)2CaO\)
Theo Định luật Bảo toàn khối lượng, ta có:
\(m_{oxit}=m_{hh\left(Na,Ca\right)}+m_{O_2}=6,3+2,4=8,7\left(g\right)\)
Em xem không hiểu đâu thì hỏi lại đó nhé!

Lời giải:
nH2 = 0,05 ⇒ nOH- = nAncol = 0,05 .2 = 0,1
Đặt nH2O = b
Áp dụng định luật bảo toàn khối lượng có 18b + 44a = 8 + 0,65 .32 (1)
Áp dụng định luật bảo toàn O có:n O(H2O) + n O(CO2) = n O(A) + n O(O2)
⇒ b + 2a = 0,65 .2 + 0,1 (2)
Từ (1) và (2) ⇒ a = 0,45
Đáp án D.
a; \(4Na+O_2\overset{t_0}{\rightarrow}2Na_2O\)
0,4 0,1 0,2
số mol Na: \(n_{Na}=\dfrac{m_{Na}}{M_{Na}}=\dfrac{9,2}{23}=0,4\left(mol\right)\)
số mol O2: \(n_{O_2}=\dfrac{V_{O_2}}{24,79}=\dfrac{4,958}{24,79}=0,2\left(mol\right)\)
lập tỉ lệ: \(\dfrac{n_{Na}}{4}=\dfrac{0,4}{4}< \dfrac{n_{O_2}}{1}=\dfrac{0,2}{1}\) (O2 dư tính theo Na)
\(m_{\text{dư}}=m_{\text{ban đầu}}-m_{\text{phản ứng}}=0,2\cdot32-0,1\cdot32=3,2\left(g\right)\)
vậy O2 dư và dư 3,2g
b; khối lượng sản phẩm thu được là:
\(m_{Na_2O}=n_{Na_2O}\cdot M_{Na_2O}=0,2\cdot62=12,4\left(g\right)\)