Hoàn thành các phương trình phản ứng sau (theo đúng tỉ lệ):
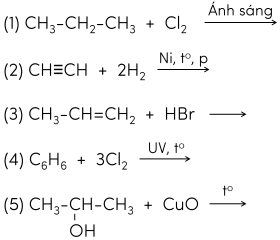
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(PTHH:2KClO_3\xrightarrow[MnO_2]{t^o}2KCl+3O_2\\ \text{Số phân tử }KClO_3:\text{Số phân tử }O_2=2:3\)

\(a,4K+O_2\xrightarrow{t^o}2K_2O\\ \text{Số nguyên tử K }:\text{Số phân tử }O_2=4:1\)

Chọn B.
(1) HOOCCH2COOCH3 (X) + 2NaOH → CH2(COONa)2 + CH3OH + H2O
(2) CH3OH (X2) + CuO → HCHO (X3) + Cu + H2O
(3) HCHO (X3) + 4AgNO3 + 6NH3 + H2O → (NH4)2CO3 + 4Ag + NH4NO3
(4) CH2(COONa)2 (X1) + 2NaOH → CH4 (X4) + 2Na2CO3
(5) 2CH4 (X4) → C2H2 (X5) + 3H2
B. Sai, X có 6 nguyên tử H trong phân tử

Chọn A.
(1) HOOCCH2COOCH3 (X) + 2NaOH → CH2(COONa)2 + CH3OH + H2O
(2) CH3OH (X2) + CuO → HCHO (X3) + Cu + H2O
(3) HCHO (X3) + 4AgNO3 + 6NH3 + H2O → (NH4)2CO3 + 4Ag + NH4NO3
(4) CH2(COONa)2 (X1) + 2NaOH → CH4 (X4) + 2Na2CO3
(5) 2CH4 (X4) → C2H2 (X5) + 3H2
A. Sai, X có 6 nguyên tử H trong phân tử

Chọn đáp án A
♦ đốt E có nO2 = nCO2 ⇒ E dạng cacbohiđrat C?(H2O)?? mà E là este 2 chức ⇒ ?? =4.
Lại có E mạch hở, được tạo thành tử một axit không no, hai chức và hai ancol no, đơn chức
E + 2H2 ⇒ E có 2πC=C, thêm 2πC=O ⇒ ∑πtrong E = 4. E dạng C?H8O4
⇒ có phương trình 8 = 2 × (số C) + 2 – 2 × 4 ⇒ số CE = 7 → CTPT của E là C7H8O4.
cấu tạo duy nhất thỏa mãn E là CH3OOC–C≡C–COOC2H5.
⇒ các phát biểu B, C, D đều đúng (chú ý G là sản phẩm thủy phân của T nhé.!).
Chỉ có phát biểu A sai

1) \(Zn+2HCl\rightarrow ZnCl_2+H_2\) (pư thế)
2) \(2H_2O\underrightarrow{đp}2H_2+O_2\) (pư phân hủy)
3) \(2Al+3H_2SO_4\rightarrow Al_2\left(SO_4\right)_3+3H_2\)(pư thế)
4) \(2Mg+O_2\underrightarrow{t^o}2MgO\) (pư hóa hợp)
5) \(2KClO_3\underrightarrow{MnO_2,t^o}2KCl+3O_2\) (pư phân hủy)
6) \(H_2+CuO\underrightarrow{t^o}Cu+H_2O\) (pư oxi hóa-khử)
7) \(P_2O_5+3H_2O\rightarrow2H_3PO_4\) (pư hóa hợp)
8) \(Na_2O+H_2O\rightarrow2NaOH\) (pư hóa hợp)
9) \(2Na+2H_2O\rightarrow2NaOH+H_2\) (pư thế)
10) \(2SO_2+O_2\underrightarrow{t^o,V_2O_5}2SO_3\) (pư hóa hợp)
\(Zn+2HCl\rightarrow ZnCl_2+H_2\\
2H_2O\underrightarrow{\text{đ}p}2H_2+O_2\\
2Al+3H_2SO_{\text{ 4}}\rightarrow Al_2\left(SO_4\right)_3+3H_2\\
\)
\(2Mg+O_2\underrightarrow{t^o}2MgO\\
2KClO_3\xrightarrow[xtMnO_2]{t^o}2KCl+3O_2\\
CuO+H_2\underrightarrow{t^o}Cu+H_2O\\
P_2O_5+3H_2O\rightarrow2H_3PO_4\\
Na_2O+H_2O\rightarrow2NaOH\\
Na+H_2O\rightarrow NaOH+\dfrac{1}{2}H_2\\
2SO_2+O_2\xrightarrow[xtV_2O_5]{t^o}2SO_3\)
(1) CH3-CH2-CH3 + Cl2 (Ánh sáng) → CH3-CH2-CH2Cl + HCl (2) CH≡CH + 2H2 (Ni, t°, P) → CH3-CH3 (3) CH3-CH=CH2 + HBr → CH3-CHBr-CH3 (4) C6H6 + 3Cl2 (UV, t°) → C6H6Cl6 (5) CH3-CH(OH)-CH3 + CuO (t°) → CH3-CO-CH3 + H2O + Cu