cho 12.3 gam hỗ hợp Cu và Al vào HCl thu đc h2 ở Dktc a,tính % chất Cu và Al b,tính tổng mol ãit đã dùng
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


mCu = 2 (g)
Gọi số mol Al, Fe là a, b (mol)
=> 27a + 56b = 10,3 - 2 = 8,3 (1)
\(n_{H_2}=\dfrac{5,6}{22,4}=0,25\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
a--------------------->1,5a
Fe + 2HCl --> FeCl2 + H2
b---------------------->b
=> 1,5a + b = 0,25 (2)
(1)(2) => a = 0,1 (mol); b = 0,1 (mol)
=> \(\left\{{}\begin{matrix}\%Al=\dfrac{0,1.27}{10,3}.100\%=26,21\%\\\%Fe=\dfrac{0,1.56}{10,3}.100\%=54,37\%\\\%Cu=\dfrac{2}{10,3}.100\%=19,42\%\end{matrix}\right.\)
\(n_{HCl}=2.n_{H_2}=0,5\left(mol\right)\)
=> \(V_{dd.HCl}=\dfrac{0,5}{2}=0,25\left(l\right)\)

\(n_{H_2}=\dfrac{6.72}{22.4}=0.3\left(mol\right)\)
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(0.2.....................................0.3\)
\(m_{Cu}=10-0.2\cdot27=4.6\left(g\right)\)
\(n_{Cu}=\dfrac{4.6}{64}=\dfrac{23}{320}\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(2Cu+O_2\underrightarrow{^{^{t^0}}}2CuO\)
\(V_{O_2}=\left(\dfrac{3}{4}\cdot0.2+\dfrac{23}{320\cdot2}\right)\cdot22.4=4.165\left(l\right)\)

\(n_{H_2}=\dfrac{3,36}{22,4}=0,15\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
0,1<-------------------------0,15
=> \(\%m_{Al}=\dfrac{0,1.27}{9,1}.100\%=29,67\%=>\%m_{Cu}=100\%-29,67\%=70,33\%\)

So sánh các phản ứng của hỗn hợp X với oxi và hỗn hợp Y với dung dịch HCl, ta thấy :
n HCl = 2 n trong oxit ; m O 2 = 8,7 - 6,7 = 2g
n O trong oxit = 0,125 mol; n HCl = 0,25 mol
V HCl = 0,25/2 = 0,125l

- Chất rắn không tan là Cu.
Gọi: \(\left\{{}\begin{matrix}n_{Al}=x\left(mol\right)\\n_{Fe}=y\left(mol\right)\end{matrix}\right.\) ⇒ 27x + 56y = 17,4 - 6,4 (1)
PT: \(2Al+6HCl\rightarrow2AlCl_3+3H_2\)
\(Fe+2HCl\rightarrow FeCl_2+H_2\)
Theo PT: \(n_{H_2}=\dfrac{3}{2}n_{Al}+n_{Fe}=\dfrac{3}{2}x+y=\dfrac{9,916}{24,79}=0,4\left(mol\right)\left(2\right)\)
Từ (1) và (2) \(\Rightarrow\left\{{}\begin{matrix}n_{Al}=0,2\left(mol\right)\\n_{Fe}=0,1\left(mol\right)\end{matrix}\right.\)
\(\Rightarrow\left\{{}\begin{matrix}m_{Al}=0,2.27=5,4\left(g\right)\\m_{Fe}=0,1.56=5,6\left(g\right)\end{matrix}\right.\)

\(a) m_{Cu} = 9,6(gam)\\ n_{Al} = a(mol) ; n_{Fe} = b(mol)\\ \Rightarrow 27a + 56b = 16,55 -9,6 =6,95(1)\\ 2Al + 6HCl \to 2AlCl_3 + 3H_2\\ Fe + 2HCl \to FeCl_2 + H_2\\ n_{H_2} = 1,5a + b = \dfrac{3,92}{22,4} = 0,175(2)\\ (1)(2) \Rightarrow a = 0,05 ; b = 0,1\\ m_{Al} = 0,05.27 = 1,35(gam); n_{Fe} = 0,1.56 = 5,6(gam)\)
\(b) n_{HCl} = 2n_{H_2} = 0,175.2 = 0,35(mol) \Rightarrow m_{HCl} = 0,35.36,5 = 12,775(gam)\)

\(n_{HCl}=0,2.1=0,2\left(mol\right)\)
\(m_{Al}=12,9-2,9=10\left(g\right)\)
\(n_{Al}=\dfrac{10}{27}\approx0,37\left(mol\right)\)
PTHH :
\(2Al+6HCl\rightarrow2AlCl_3+3H_2\uparrow\)
0,066 0,2
\(\dfrac{0,37}{2}>\dfrac{0,2}{6}\) --> Tính theo HCl
\(m_{Alpu}=0,66.27=1,8\left(g\right)\)
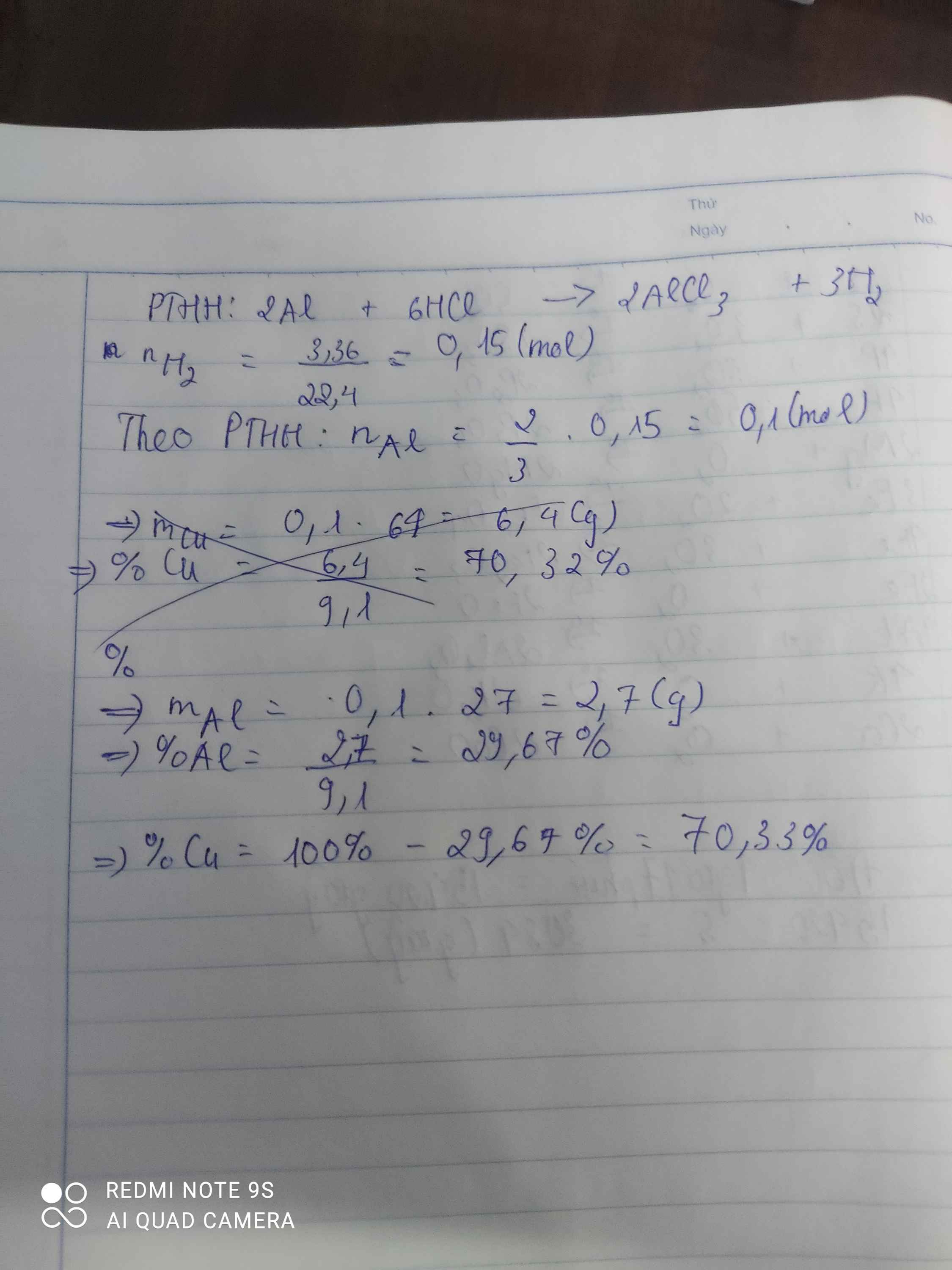
Đề bị thiếu dữ kiện nha em