nêu các nhận biết các dung dịch sau :naOH ,H2SO4,KNO3,K2SO4
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


Trích mẫu thử
1) Cho quỳ tím vào các mẫu thử
- mẫu thử nào làm quỳ tím hóa xanh là NaOH
- mẫu thử nào làm quỳ tím hóa đỏ là HCl
Cho dung dịch $BaCl_2$ vào hai mẫu thử còn :
- mẫu thử tạo kết tủa trắng là $Na_2SO_4$
$Na_2SO_4 + BaCl_2 \to BaSO_4 + 2NaCl$
- mẫu thử không hiện tượng là $KNO_3$
2) Cho quỳ tím vào các mẫu thử
- mẫu thử nào làm quỳ tím hóa xanh là $KOH$
- mẫu thử nào làm quỳ tím hóa đỏ là $H_2SO_4$
Cho dung dịch $BaCl_2$ vào hai mẫu thử còn :
- mẫu thử tạo kết tủa trắng là $K_2SO_4$
$K_2SO_4 + BaCl_2 \to BaSO_4 + 2KCl$
- mẫu thử không hiện tượng là $KCl$

Cho quỳ tím vào các mẫu thử
+ Quỳ hóa đỏ: H2SO4
+ Quỳ hóa xanh: NaOH
+ Quỳ không đổi màu: NaCl, Na2SO4
Cho dung dịch BaCl2 vào 2 mẫu làm quỳ không đổi màu
+ Mẫu thử nào có kết tủa: Na2SO4
\(Na_2SO_4+BaCl_2\rightarrow BaSO_4+2NaCl\)
+ Không hiện tượng: NaCl

a) dùng quỳ tím nhận H2SO4 , sau đó dùng muối AgNO3 nhận NaCl
NaCl + AgNO3 → NaNO3 + AgCl ↓
b) dùng quỳ tím nhận HCl, sau đó dùng muối BaCl2 nhận K2SO4
BaCl2 + K2SO4 → KCl + BaSO4 ↓
c)dùng quỳ tím nhận H2SO4, NaOH sau đó dùng muối BaCl2 nhận Na2SO4
d) dùng quỳ tím nhận KOH, H2SO4 sau đó dùng muối BaCl2 nhận K2SO4

a)
_Trích mẫu thử, đánh STT_
Cho các mẫu thử lần lượt tác dụng với dd AgNO3, sau đó nhúng QT:
- Có kết tủa màu trắng, QT hoá đỏ: HCl
\(AgNO_3+HCl\rightarrow AgCl\downarrow+HNO_3\)
- Có kết tủa màu đen, QT không đổi màu: NaOH
\(2AgNO_3+2NaOH\rightarrow2NaNO_3+Ag_2O\downarrow+H_2O\)
- Có kết tủa màu trắng, QT không đổi màu: K2SO4
\(2AgNO_3+K_2SO_4\rightarrow Ag_2SO_4\downarrow+2KNO_3\)
- Có kết tủa màu vàng cam: K2CO3
\(2AgNO_3+K_2CO_3\rightarrow Ag_2CO_3\downarrow+2KNO_3\)
_Dán nhãn_
b)
_Trích mẫu thử, đánh STT_
Hoà các mẫu thử vào nước, sau đó nhúng QT:
- Tan, QT hoá đỏ: HCl
- Tan, QT hoá xanh: Ba(OH)2
- Không tan: CaCO3
- Tan, QT không đổi màu: KNO3
_Dán nhãn_
trích 1 ít dung dịch ra làm mẫu thử rồi đánh stt
rồi nhỏ vài giọt vào QT
QT hóa xanh => NaOH
QT hóa đỏ => HCl
QT không đổi màu => K2SO4 , K2CO3
cho HCl tác dụng với 2 mẫu thử còn lại
có khí => K2CO3
không hiện tượng => K2SO4
dán nhãn
b) trích 1 ít dung dịch ra làm mẫu thử rồi đánh stt
rồi nhỏ vài giọt vào QT
QT hóa xanh => Ba(OH)2
QT hóa đỏ => HCl
QT không đổi màu => CaCO3 , KNO3
cho 2 dung dịch vào nước cất
tan => KNO3
không tan => CaCO3
dán nhãn

- Trích mẫu thử và đánh dấu từng mẫu thử
- Dùng giấy qùy tím cho vào từng mẫu thử:
+ Mẫu thử nào làm quỳ tím hóa đỏ là Axit Sunfuric (H2SO4)
+ Mẫu thử nào làm quỳ tím hóa xanh là Natri Hidroxit (NaOH)
+ Mẫu thử nào làm quỳ tím không đổi màu là Kali Nitrat và Natri Clorua (KNO3;NaCl)
+ Cho AgNO3 vào 2 mẫu thử:
- Tạo kết tủa trắng: NaCl
- Còn lại: KNO3
PTHH: \(NaCl+AgNO_3\rightarrow NaNO_3+AgCl\)

a, HCl;H2SO4;NaCl;Na2SO4
- Dùng quỳ tím:
+ Làm quỳ hóa đỏ: HCl;H2SO4 (1)
+ Không làm quỳ đổi màu: NaCl;Na2SO4 (2)
- Dùng dd BaCl2
+ Nhóm 1:
- Xuất hiện kết tủa: H2SO4
- Không có hiện tương: HCl
+ Nhóm 2:
- Xuất hiện kết tủa trắng: Na2SO4
- Không có hiện tượng: NaCl
PTHH :
BaCO3+H2SO4 → BaSO4+CO2+H2O
Na2SO4+BaCl2 → BaSO4+2NaCl
b, NaOH;NH4Cl;KNO3;H2SO4
- Dùng quỳ tím
+ Làm quỳ hóa đỏ: H2SO4
+ Làm quỳ hóa xanh: NaOH
+ Không làm quỳ đổi màu: NH4Cl;KNO3 (*)
- Cho dd NaOH vào các lọ nhóm (*)
+ Xuất hiện khí mùi khai: NH4Cl
+ Không có hiện tượng: KNO3
PTHH:
NH4Cl+KOH → KCl+NH3+H2O
c, NaOH;NH4NO3;K2SO4;HCl
- Dùng quỳ tím
+ Làm quỳ hóa đỏ: H2SO4
+ Làm quỳ hóa xanh: NaOH
+ Không làm quỳ đổi màu: NH4NO3;K2SO4 (*)
- Cho dd BaCl2 vào các lọ nhóm (*)
+ Xuất hiện kết tủa trắng: K2SO4
+ Không xảy ra hiện tương: NH4NO3
PTHH:
NH4NO3+KOH → KNO3+NH3+H2O
d, Na2CO3;NaOH;H2SO4;NH4Cl
- Dùng quỳ tím
+ Làm quỳ hóa đỏ: H2SO4
+ Làm quỳ hóa xanh: NaOH
+ Không làm quỳ đổi màu: Na2CO3;NH4Cl (1)
- Cho dd HCl vào các lọ nhóm (1)
+ Lọ có bọt khí không màu thoát ra: Na2CO3
+ Không xảy ra hiện tượng: NH4Cl
PTHH:
Na2CO3+2HCl → 2NaCl+CO2+H2O
e, O3;SO2;CO2
- Dần các khí qua dd nước brom
+ Làm mất màu dd nước brom: SO2
+ Không làm mất màu: CO2;O3
- Dẫn O3,CO2 qua dd nước vôi trong dư
+ Xuất hiện vẩn đục màu trắng: CO2
+ Không có hiện tượng: O3
PTHH:
SO2+2H2O+Br2 → 2HBr+H2SO4
CO2+Ca(OH)2 → CaCO3+H2O
g, O2;Cl2;HCl
- Dùng quỳ tím ẩm
+ Làm quỳ hóa đỏ: HCl
+ Làm quỳ hóa đỏ sau đó mất màu hoàn toàn: Cl2
+ Không làm quỳ đổi màu: O2

Xử lí bài tập nhận biết, ta chỉ cần thử 1 trong 5 hóa chất hữu dụng sau: Ba(OH)2, H2SO4, AgNO3, Quì tím, HCl. Trích mỗi ống nghiệm ra làm nhiều mẫu thử, đánh số thứ tự để thuận tiện đối chiếu kết quả thực nghiệm.
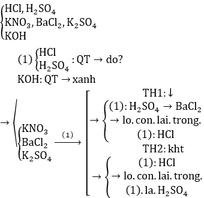
Lấy ngẫu nhiên 1 lọ thuộc nhóm (1) (nhóm axit) để nhận biết nhóm (2)
Dùng BaCl2 nhận biết KNO3 và K2SO4
Pt: BaCl2 + H2SO4 → 2HCl + BaSO4↓
BaCl2 + K2SO4 → 2KCl + BaSO4↓

a, - Trích mẫu thử.
- Nhỏ từng mẫu thử vào quỳ tím.
+ Quỳ hóa đỏ: HNO3, H2SO4 (1)
+ Quỳ hóa xanh: KOH
+ Quỳ không đổi màu: KNO3
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: H2SO4
PT: \(BaCl_2+H_2SO_4\rightarrow2HCl+BaSO_4\)
+ Không hiện tượng: HNO3
- Dán nhãn.
b, - Trích mẫu thử.
- Nhỏ từng mẫu thử vào quỳ tím.
+ Quỳ hóa đỏ: HCl, H2SO4 (1)
+ Quỳ hóa xanh: NaOH
+ Quỳ không đổi màu: NaCl
- Cho mẫu thử nhóm (1) pư với dd BaCl2
+ Có tủa trắng: H2SO4
PT: \(H_2SO_4+BaCl_2\rightarrow2HCl+BaSO_4\)
+ Không hiện tượng: HCl
- Dán nhãn.

Trích mẫu thử, cho quỳ tím vào các mẫu thử:
- Hóa đỏ: \(HCl,H_2SO_4\)
- Hóa xanh: \(Ba(OH)_2\)
- Ko đổi màu: \(KNO_3,K_2SO_4\)
Cho dd \(BaCl_2\) vào dd làm quỳ hóa đỏ:
- Tạo KT trắng: \(H_2SO_4\)
- Ko ht: \(HCl\)
Cho tiếp dd \(BaCl_2\) vào dd làm quỳ ko đổi màu:
- Tạo KT trắng: \(K_2SO_4\)
- Ko ht: \(KNO_3\)
\(BaCl_2+H_2SO_4\to BaSO_4\downarrow+2HCl\\ BaCl_2+K_2SO_4\to BaSO_4\downarrow+2KCl\)
- Cho các dd tác dụng với quỳ tím
+ QT chuyển đỏ: HCl, H2SO4 (1)
+ QT chuyển xanh: Ba(OH)2
+ QT không chuyển màu: KNO3, K2SO4 (2)
- Cho Ba(OH)2 tác dụng với các dung dịch ở (1)
+ Kết tủa trắng: H2SO4
Ba(OH)2 + H2SO4 --> BaSO4\(\downarrow\) + 2H2O
+ Không hiện tượng: HCl
Ba(OH)2 + 2HCl --> BaCl2 + 2H2O
- Cho dd ở (2) tác dụng với dd Ba(OH)2
+ Kết tủa trắng: K2SO4
K2SO4 + Ba(OH)2 --> BaSO4\(\downarrow\) + 2KOH
+ Không hiện tượng: KNO3
Trích mẫu thử
Cho giấy quỳ tím vào mẫu thử :
- mẫu thử nào làm quỳ tím hóa đỏ là H2SO4
- mẫu thử nào làm quỳ tím hóa xanh là NaOH
Cho dung dịch Bari Clorua vào các mẫu thử còn :
- mẫu thử nào tạo kết tủa trắng là K2SO4
\(K_2SO_4 + BaCl_2 \to 2KCl + BaSO_4\)
- mẫu thử không hiện tượng là KNO3
Cho quỳ tím vào
--> Hóa xanh: NaOH
--> Hóa đỏ: H2SO4
--> Ko hiện tượng: KNO3, K2SO4.
Cho BaCl2 vào các chất còn lại
--> Kết tủa: K2SO4
--> Còn lại: KNO3.
PTPU: K2SO4 + BaCl2 -> 2KCl + BaSO4