nhiệt phân hoàn toàn 0,1 mol CU(OH)2 khối lượng CuO thu được là
A:7,5g
B: 8g
C:7,8g
D:7g
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

PTHH: \(Cu\left(OH\right)_2\xrightarrow[]{t^0}CuO+H_2O\)
\(n_{Cu\left(OH\right)_2}=\dfrac{49}{98}=0,5\left(mol\right)\)
\(n_{CuO}=n_{Cu\left(OH\right)_2}=0,5\left(mol\right)\)
\(m_{CuO}=0,5.80=40\left(g\right)\)

a, \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)\)
PT: \(Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O\)
Theo PT: \(n_{Cu\left(OH\right)_2}=n_{CuO}=0,05\left(mol\right)\)
\(\Rightarrow m_{Cu\left(OH\right)_2}=0,05.98=4,9\left(g\right)\)
b, \(m_{H_2SO_4}=250.9,8\%=24,5\left(g\right)\Rightarrow n_{H_2SO_4}=\dfrac{24,5}{98}=0,25\left(mol\right)\)
PT: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Xét tỉ lệ: \(\dfrac{0,05}{1}< \dfrac{0,25}{1}\), ta được H2SO4 dư.
Theo PT: \(n_{CuSO_4}=n_{H_2SO_4\left(pư\right)}=n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\)
\(\Rightarrow n_{H_2SO_4\left(dư\right)}=0,25-0,05=0,2\left(mol\right)\)
\(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05.160}{4,9+250}.100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2.98}{4,9+250}.100\%\approx7,69\%\end{matrix}\right.\)

Đáp án D
Fe2+ + 2OH- → Fe(OH)2
Cu2+ + 2OH- → Cu(OH)2
Ba2++ SO42- → BaSO4
0,1 mol 0,1 mol 0,1 mol
nOH-= 2.nFe2++ 2.nCu2+=0,4 mol= (V.0,1.2+V.0,2)/1000 suy ra V= 1000 ml
Sau khi nung nóng thu được chất rắn khan có chứa:
Fe2O3: 0,05 mol; CuO: 0,1 mol; BaSO4: 0,1 mol có tổng khối lượng là 39,3 gam

a) PTHH: \(Cu\left(OH\right)_2\xrightarrow[]{t^o}CuO+H_2O\)
Ta có: \(n_{CuO}=\dfrac{4}{80}=0,05\left(mol\right)=n_{Cu\left(OH\right)_2}\) \(\Rightarrow m_{Cu\left(OH\right)_2}=0,05\cdot98=4,9\left(g\right)\)
b) PTHH: \(Cu\left(OH\right)_2+H_2SO_4\rightarrow CuSO_4+2H_2O\)
Ta có: \(\left\{{}\begin{matrix}n_{Cu\left(OH\right)_2}=0,05\left(mol\right)\\n_{H_2SO_4}=\dfrac{250\cdot9,8\%}{98}=0,25\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\) Axit còn dư
\(\Rightarrow\left\{{}\begin{matrix}n_{CuSO_4}=0,05\left(mol\right)\\n_{H_2SO_4\left(dư\right)}=0,2\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}C\%_{CuSO_4}=\dfrac{0,05\cdot160}{4,9+250}\cdot100\%\approx3,14\%\\C\%_{H_2SO_4\left(dư\right)}=\dfrac{0,2\cdot98}{4,9+250}\cdot100\%\approx7,7\%\end{matrix}\right.\)

Chọn đáp án C
Gọi một α-aminoaxit tạo nên X và Y là C n H 2 n + 1 O 2 N
Suy ra X và Y lần lượt có CTCT là C 3 n H 6 n - 1 O 4 N 3 v à C 2 n H 4 n O 3 N 2
⇒ 24 , 8 = 44 ( 2 n . 0 , 1 ) + 18 ( 0 , 1 . 2 n ) ⇒ n = 2 ⇒ X : C 6 H 11 O 4 N 5
Khi đốt cháy 0,1 mol X ta thu được 0,6 mol C O 2 và 0,55 mol H 2 O , hấp thụ hết vào C a ( O H ) 2 thì khối lượng dung dịch giảm 23,7g.

Đáp án : C
Giả sử 2 peptit đều cấu tạo từ CnH2n+1O2N
=> X là : C3nH6n-1O4N3 và Y là C2nH4nO3N2
Đốt 0,1 mol Y : nCO2 = 0,2n (mol) ; nH2O = 0,2n (mol)
Lại có mCO2 + mH2O = 24,8g => n = 2
=> X là C6H11O4N3 khi đốt cháy : nCO2 = 6nX = 0,6 mol = nCaCO3 ; nH2O = 0,55 mol
, mCaCO3 – (mH2O + mCO2) = 23,7g => dung dịch có khối lượng giảm 23,7g
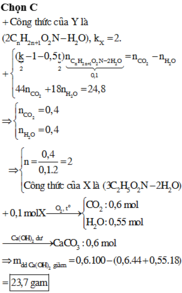
\(PTHH:Cu\left(OH\right)_2\underrightarrow{t^o}CuO+H_2O \\ Mol:0,1\rightarrow0,1\\ m_{CuO}=0,1.80=8\left(g\right)\\ \Rightarrow B\)
d