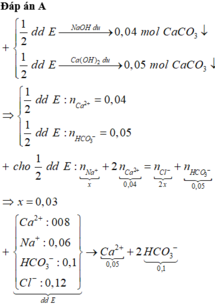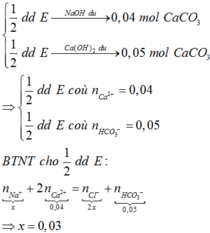Cho một dung dịch chứa 0,23 gam Na+; 0,48 gam Mg2+; 0,96 gam và x gam . Mệnh đề nào dưới đây không đúng?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.



Chọn đáp án B.
nNa+ = 0,23/23 = 0,01; nMg2+ = 0,48/24 = 0,02 và nSO42- = 0,96/96 = 0,01
BTĐT => n N O 3 - = 0,01 + 0,02 × 2– 0,01 × 2 =0,03 => m N O 3 - = 0,03 × 62 = 1,86 gam => Đáp án D đúng.
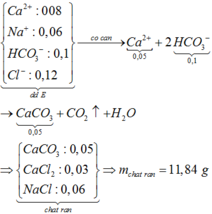
Đáp án A đúng vì BaCl2 dư => Toàn bộ S O 4 2 - kết tủa hết => mBaSO4 = 233 × 0,01 = 2,33 gam
Đáp án B sai vì nếu là Mg(NO3)2 thì n N O 3 - = 2 × 0,02 > 0,03
Đáp án C đúng vì mRắn khan = 0,23 + 0,48 + 0,96 + 1,86 = 3,53 gam.

Đáp án A
Định luật bảo toàn điện tích suy ra
nSO4(2-)=(0,01.1+ 5.10-3.2- 0,01)/2=0,005 mol
Khối lượng muối khan thu được là: 0,23+ 0,12+ 0,355+ 0,005.96= 1,185 gam

\(n_{Na^+}=\dfrac{0,23}{23}=0,01\left(mol\right);n_{Mg^{2+}}=\dfrac{0,12}{24}=0,005\left(mol\right);n_{Cl^-}=\dfrac{0,355}{35,5}=0,01\left(mol\right)\)
Bảo toàn điện tích :
\(n_{SO_4^{2-}}=\dfrac{0,01+0,005.2-0,01}{2}=0,005\left(mol\right)\\ m_{muối}=0,23+0,12+0,355+0,005.96=1,185\left(gam\right)\)

Đề thiếu:
Dung dịch A chứa 0,23 gam ion Na+; 0,12 gam ion Mg2+; 0,355 gam ion Cl- và m gam ion SO42–. Số gam muối khan sẽ thu được khi cô cạn dung dịch A là:
Ta có dung dịch A có chứa 0,01 mol Na+; 0,005 mol Mg2+; 0,01 mol Cl-
Suy ra số mol SO42- là: 0,01.1+0,005.2 = 0,01.1 + 2.
⇒ = 0,005 (mol)
Khối lượng gốc sunfat là: 0,005.96 = 0,48 gam
Số gam muối khan thu được khi cô cạn dung dịch A là:
0,23 + 0,12 + 0,355 + 0,48 = 1,185 (gam)