Trộn ba dung dịch HCl 0,15M ; HNO3 0,3M và H2SO4 0, 3M với thể tích bằng nhau thu được dung dịch X. Cho 100 ml dung dịch X vào dung dịch chứa 0,005 mol KOH và 0,005 mol Ba(AlO2)2 . Khối lượng kết tủa thu được là :
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án A
Gọi thể tích dung dịch A là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch B là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9

Chọn B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
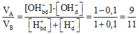

Đáp án B.
Nồng độ H+ ban đầu là: (0,2 + 0,3 + 0,1.2 + 0,3) = 1M.
Nồng độ OH- ban đầu là: (0,3 + 0,4 + 0,15.2) = 1M.
Dung dịch sau phản ứng có pH = 13, suy ra OH- dư, pOH = 1.
Nồng độ OH- dư là: 10-1 = 0,1M.
Áp dụng sơ đồ đường chéo cho trường hợp OH- dư, ta được:
VA/VB = (1-0,1)/(1+0,1) = 9/11

a, \(n_{HCl}=0,2.0,1=0,02\left(mol\right)=n_{H^+}=n_{Cl^-}\)
\(n_{H_2SO_4}=0,2.0,15=0,03\left(mol\right)=n_{SO_4^{2-}}\) \(\Rightarrow n_{H^+}=2n_{H_2SO_4}=0,06\left(mol\right)\)
\(\Rightarrow\Sigma n_{H^+}=0,02+0,06=0,08\left(mol\right)\)
\(n_{Ba\left(OH\right)_2}=0,3.0,05=0,015\left(mol\right)=n_{Ba^{2+}}\)
\(\Rightarrow n_{OH^-}=2n_{Ba\left(OH\right)_2}=0,03\left(mol\right)\)
\(H^++OH^-\rightarrow H_2O\)
0,03___0,03 (mol) ⇒ nH+ dư = 0,05 (mol)
\(Ba^{2+}+SO_4^{2-}\rightarrow BaSO_4\)
0,015___0,015______0,015 (mol) ⇒ nSO42- dư = 0,015 (mol)
⇒ m = mBaSO4 = 0,015.233 = 3,495 (g)
\(\left[Cl^-\right]=\dfrac{0,02}{0,2+0,3}=0,04\left(M\right)\)
\(\left[H^+\right]=\dfrac{0,05}{0,2+0,3}=0,1\left(M\right)\)
\(\left[SO_4^{2-}\right]=\dfrac{0,015}{0,2+0,3}=0,03\left(M\right)\)
b, pH = -log[H+] = 1

Đáp án C
nOH- ban đầu = 0,009
nH+ ban đầu = 0,04a
V sau = 40 + 60 = 100 ml = 0,1 lít
Dung dịch thu được có pH bằng 2 ⇒ nH+ lúc sau = 0,1.0,01 = 0,001
n H+ ban đầu = n OH- + nH+ lúc sau
⇒ 0,04a = 0,009 + 0,001 ⇒ a = 0,25
Đáp án C.

Gọi thể tích dung dịch X là V1 lít. Có nH+ = ( 0,2+0,3+0,1.2+0,3).V1 = V1 mol
Gọi thể tích dung dịch Y là V2 lít. Có nOH- = ( 0,3+ 0,4+ 0,15.2).V2 = V2 mol
H+ + OH- → H2O
V1 V2
Dung dịch thu được có pH = 13 nên OH- dư
nOHdư = V2- V1 mol
[OH-]dư = (V2-V1)/(V2+ V1) = 10-1 suy ra V1: V2 = 11:9
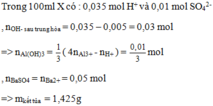
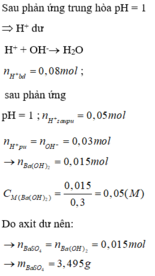

Đáp án D
X có : 0,035 mol H+ và 0,01 mol SO42-
nOH- sau trung hòa = 0,035 – 0,005 = 0,03 mol
=> nAl(OH)3 = 1/3(4nAl3+ - nH+ ) = 0,01/3 mol
nBaSO4 = nBa2+ = 0,05 mol
=> m kết tủa = 1,425g