Dung dịch X gồm CuCl2 0,2M; FeCl2 0,3M; FeCl3 0,3M. Cho m gam bột Mg vào 100 ml dung dịch X khuấy đều đến khi phản ứng kết thúc thu được dung dịch Y. Thêm dung dịch KOH dư vào Y được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi thu được 5,4 gam chất rắn T. Giá trị của m là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
+ B ả n c h ấ t p h ả n ứ n g : F e C l 3 C u C l 2 → H 2 S d ư S ↓ C u S ↓ + H C l F e C l 2 + B T E : 2 n S = n F e C l 3 = 0 , 02 B T N T : n C uS = n C u C l 2 = 0 , 02 ⇒ n S = 0 , 01 ; n C uS = 0 , 02 m ( C uS , S ) = 2 , 24 g a m

Đáp án A
n C u C l 2 = 0 , 2 . 0 , 4 = 0 , 08 m o l → m C u C l 2 = 0 , 08 . 135 = 10 , 8 g a m

\(n_{AgNO3}=0,5.0,3=0,15\left(mol\right)\)
\(n_{KCl}=0,2.0,1=0,02\left(mol\right)\)
\(n_{CuCL2}=0,2.0,1=0,02\left(mol\right)\)
\(PTH:AgNO_3+KCl\rightarrow AgCl+KNO_3\)
______ 0,02________0,02__0,02____________
Tỉ lệ :\(\frac{0,15}{1}>\frac{0,02}{1}\)
Nên KCl hết, AgNO3 dư, pt tính theo số mol KCl
\(\Rightarrow m_{AgCl}=0,02.\left(108+35,5\right)=2,87\left(g\right)\)
\(\Rightarrow n_{AgNO3+dư}=0,15-0,02=0,13\left(mol\right)\)
\(PTHH:2AgNO_3+CuCl_2\rightarrow2AgCl+Cu\left(NO_3\right)_2\)
______0,04 _________0,02_____ 0,04______________
Tỉ lệ :\(\frac{0,13}{2}>\frac{0,02}{1}\)
Nên AgNO3 còn dư, CuCl2 phản ứng hết, pt tính theo nCuCl2
\(\Rightarrow m_{AgCl}=0,04.\left(108+35,5\right)=5,74\left(g\right)\)
\(\Rightarrow\Sigma m_{AgCl}=2,87+5,74=8,61\left(g\right)\)

Đáp án : C
0 , 03 m o l N a H C O 3 0 , 06 m o l K 2 C O 3 nhỏ từ từ 0 , 02 m o l H C l 0 , 06 m o l K H S O 4
=> 2 muối kiềm sẽ phản ứng theo tỉ lệ mol 1:2
Đặt số mol NaHCO3 phản ứng là x => số mol KCO3 phản ứng là 2x
=> nH+ = 0,02 + 0,06 = x + 2.2x => x = 0,016 mol
=> Sau phản ứng có : 0,014 mol HCO3- ; 0,028 mol CO32- và 0,06 mo SO42-
Khi cho X vào dung dịch chứa : 0,06 mol KOH và 0,15 mol BaCl2
=> nCO3 = 0,014 + 0,028 = 0,042 mol ; nSO4 = 0,06 mol
=> m kết tủa = mBaCO3 + mBaSO4 = 22,254g
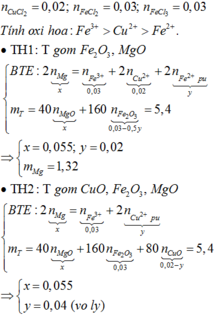



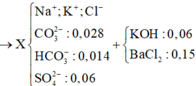
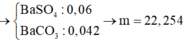


Đáp án C
+ n C u C l 2 = 0 , 02 m o l ; n F e C l 2 = 0 , 03 m o l ; n F e C l 3 = 0 , 03 m o l . + T í n h o x i h ó a : F e 3 + > C u 2 + > F e 2 + . ∙ TH 1 : T g ồ m F e 2 O 3 , M g O B T E : 2 n M g ⏟ x = n F e 3 + ⏟ 0 , 03 + 2 n C u 2 + ⏟ 0 , 02 + 2 n F e 2 + p ¨ o ⏟ y m T = 40 n M g O ⏟ x + 160 n F e 2 O 3 ⏟ 0 , 03 - 0 , 5 y = 5 , 4 ⇒ x = 0 , 055 ; y = 0 , 02 m M g = 1 , 32 ∙ TH 2 : T g ồ m C u O , ...