Điện phân dung dịch chứa Fe(NO3)3 ; Cu(NO3)2 với I = 10A, điện cực trơ đến khi dung dịch vừa hết màu xanh thì dừng lại, khi đó ở anot thu được 0,196 lít khí (đktc) và khối lượng dung dịch giảm 0,92g. Thời gian điện phân, số mol từng muối trước điện phân theo thứ tự trên là:
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án D
Phương pháp: Dựa vào dãy điện hóa (quy tắc α)
Hướng dẫn giải:
Kim loại thu được là Ag. Do thu được 1 KL nên Fe, Mg hết.
Thứ tự các kim loại phản ứng với AgNO 3 : Mg, Fe
TH1:
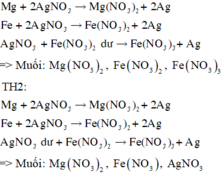

+/Bình 1: Tại Anot: 2H2O → 4H+ + O2 + 4e
Do pH = 1 => n H+ = 0,1.0,5 = 0,05 mol
Do 2 bình mắc nối tiếp nên I1 = I2 => số mol e trao đổi như nhau ở 2 bình
=> n e trao đổi = 0,05 mol
+/Bình 2: Tại Catot : Fe3+ + 1e → Fe2+ Ag+ + 1e → Ag Cu2+ + 2e → Cu
=> m = m Ag + m Cu = 108.0,02 + 64.0,01 =2,8g
=>D

(3) Điện phân dung dịch CuSO4 bằng điện cực trơ.
(4) Thổi luồng khí CO qua ống sứ chứa CuO nung nóng.
(6) Cho bột Cu vào lượng dư dung dịch AgNO3.
(7) Cho dung dịch Fe(NO3)2 vào dung dịch AgNO3.
ĐÁP ÁN C

Đáp án A
2Cu(NO3)2+2H2O→2Cu+4HNO3+O2
Hai chất tan sau khi điện phân là x mol Cu(NO3)2 và x mol HNO3
3Fe + 8H+ + 2NO3- → 3Fe2+ + 2NO + 4H2O
0,375x x
Fe + Cu2+→Fe2++Cu
x x x
=> m giảm = 56(0,375x+x)-64x = 1,56 => x = 0,12 mol => nO2 = 0,03 mol
n e = 4nO2 = 0,12 mol
=>t = 0,12.96500/3 = 3860 giây
Đáp án D