Trên hai đĩa cân đã thăng bằng, đặt hai cốc bằng nhau: Cho vào cốc bên trái 12 gam Mg; cho vào cốc bên phải 26,94 gam MgCO3, cân mất thăng bằng. Muốn cân trở lại thăng bằng như cũ phải thêm vào cốc Mg bao nhiêu gam dung dịch HCl 14,6% ?
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

a) Giả sử mỗi lá kim loại nặng 1 (g)
- Xét cốc thứ nhất:
\(n_{Fe}=\dfrac{1}{56}\left(mol\right)\)
PTHH: Fe + 2HCl --> FeCl2 + H2
\(\dfrac{1}{56}\)------------------->\(\dfrac{1}{56}\)
=> \(m_{tăng}=1-\dfrac{1}{56}.2=\dfrac{27}{28}\left(g\right)\) (1)
- Xét cốc thứ hai
\(n_{Al}=\dfrac{1}{27}\left(mol\right)\)
PTHH: 2Al + 6HCl --> 2AlCl3 + 3H2
\(\dfrac{1}{27}\)-------------------->\(\dfrac{1}{18}\)
=> \(m_{tăng}=1-\dfrac{1}{18}.2=\dfrac{8}{9}\left(g\right)\) (2)
(1)(2) => Khối lượng chất trong cốc thứ nhất tăng nhiều hơn so với khối lượng chất trong cốc thứ hai
=> Cân nghiêng về cốc thứ nhất
b)
Do thể tích khí H2 thoát ra là bằng nhau
=> Cân ở vị trí cân bằng

Đáp án D
HCl+CaCO3→CaCl2+H2O+CO2(1)
0,05 0,05 mol
HCl+M2CO3→MCl2+H2O+CO2(2)
4 , 784 2 m + 60 4 , 784 2 m + 60 mol
Sau khi hai muối đã tan hoàn toàn, cân trở lại vị trí cân bằng nên ta có:
m
C
a
C
O
3
-
m
C
O
2
(
p
u
1
)
=
m
M
2
C
O
3
-
m
C
O
2
(
p
u
2
)
5 - 0 , 05 . 44 = 4 , 784 - 44 . 4 , 784 2 M + 60
⇒ M = 23 vậy M là Na

Đáp án D
Trên đĩa cân X: khối lượng giảm 0,05.44=2,2 gam do CO2 thoát ra
Như vậy, trên cân Y cũng phải giảm (4,784-(5-2,2)=1,984) gam.

Giả sử mZn = mFe = 56 (g)
- Xét cốc 1:
\(n_{Zn}=\dfrac{56}{65}\left(mol\right)\)
PTHH: Zn + H2SO4 --> ZnSO4 + H2
\(\dfrac{56}{65}\)------------------------->\(\dfrac{56}{65}\)
Xét mZn - mH2 = 56 - \(\dfrac{56}{65}.2\) = \(\dfrac{3528}{65}\)(g)
=> Cốc 1 tăng \(\dfrac{3528}{65}\) gam (1)
- Xét cốc 2:
\(n_{Fe}=\dfrac{56}{56}=1\left(mol\right)\)
PTHH: Fe + H2SO4 --> FeSO4 + H2
1------------------------->1
Xét mFe - mH2 = 56 - 1.2 = 54 (g)
=> Cốc 2 tăng 54 gam (2)
(1)(2) => Cốc 1 có khối lượng tăng nhiều hơn so với cốc 2
=> Cân nghiêng về cốc 1

- Thí nghiệm 1 : $n_{Mg} = \dfrac{15}{24} = 0,625(mol)$
$Mg + 2HCl \to MgCl_2 + H_2$
Theo PTHH : $n_{H_2} = n_{Mg} = 0,625(mol)$
$\Rightarrow m_{tăng} = m_{Mg} - m_{H_2} = 15 - 0,625.2 = 13,75(gam)$
- Thí nghiệm 2 :
$Fe + H_2SO_4 \to FeSO_4 + H_2$
Theo PTHH : $n_{H_2} = n_{Fe} = \dfrac{a}{56}(mol)$
$m_{tăng} = a - \dfrac{a}{56}.2 = \dfrac{27a}{28}(gam)$
Mà cân ở vị trí cân bằng nên $13,75 = \dfrac{27a}{28} \Rightarrow a = 14,26(gam)$

\(n_{Fe}=\dfrac{7,84}{56}=0,14\left(mol\right);n_{Al}=\dfrac{8,1}{27}=0,3\left(mol\right)\)
PTHH: Fe + 2HCl → FeCl2 + H2
Mol: 0,14 0,14
PTHH: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
'Mol: 0,3 0,45
⇒ Khối lượng đc thêm vào ở cốc A là 7,84-0,14.2=7,56 (g)
Khối lượng đc thêm vào ở cốc B là 8,1-0,45.2=7,2 (g)
⇒ Cốc A nặng hơn cốc B (do khối lượng axit được lấy vào 2 cốc bằng nhau )
Vậy cân ko còn ở vị trí thăng bằng
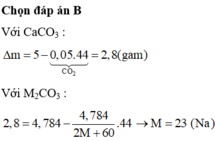

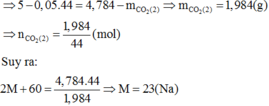
Đáp án C