Nhiệt phân hoàn toàn hỗn hợp X gồm NaNO3; Al(NO3)3; Cu(NO3)2 thu được 10 gam chất rắn Y và hỗn hợp khí Z. Hấp thụ khí Z vào 112,5 gam H2O được dung dịch axit có nồng độ 12,5% và có 0,56 lít một khí duy nhất thoát ra (đktc). % khối lượng của NaNO3 trong hỗn hợp X là
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.

Đáp án C
Phương trình phản ứng:
2NaNO3 → t 0 2NaNO2 + O2
2Zn(NO3)2 → t 0 2ZnO + 4NO2 + O2
d x / H 2 = 20 → M x ¯ = 20 . 2 = 40
Ta có hệ phương trình:
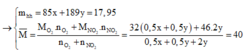
→ x = 0 , 1 y = 0 , 05
% m N a N O 3 = 47 , 35 %

Gọi số mol NO2, O2 là a, b
Có: \(\dfrac{46a+32b}{a+b}=19,5.2=39\)
=> 7a = 7b
=> a = b
PTHH: 2Mg(NO3)2 --to--> 2MgO + 4NO2 + O2
________0,5a<----------------------a----->0,25a
2NaNO3 --to--> 2NaNO2 + O2
(2b-0,5a)<------------(b-0,25a)
=> mNaNO3 = (2b-0,5a).85 = 127,5a (g)
=> mMg(NO3)2 = 0,5a.148 = 74a (g)
=> \(\left\{{}\begin{matrix}\%NaNO_3=\dfrac{127,5a}{127,5a+74a}.100\%=63,275\%\\\%Mg\left(NO_3\right)_2=\dfrac{74a}{127,5a+74a}.100\%=36,725\%\end{matrix}\right.\)

1. Phương trình hoá học của các phản ứng:
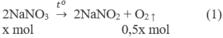
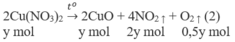
2. Đặt X và y là số mol của N a N O 3 và C u ( N O 3 ) 2 trong hỗn hợp X. Theo các phản ứng (1) và (2) số mol NO2 thu được là 2y mol và tổng số mol oxi là (0,5x + 0,5y) mol.
Biết khối lượng mol của hai chất N a N O 3 và Cu(NO3)2 tương ứng là 85 và 188 (g/mol), ta có hệ phương trình :
85x + 188y = 27,3 (a)
0,5x + 2y + 0,5y = 0,3 (b)
Giải hệ phương trình (a), (b) được : x = y = 0,1.
Phần trăm khối lượng của mỗi muối trong hỗn hợp X :
![]()
% m C u ( N O 3 ) 2 = 100% - 31,1% = 68,9%

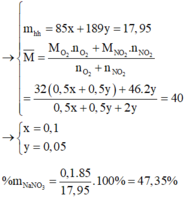
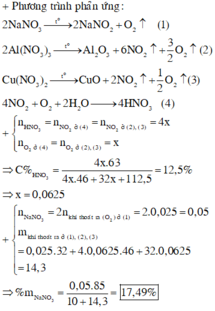

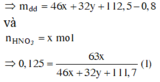
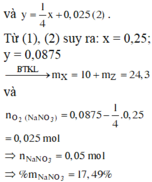
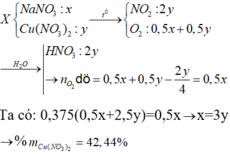
Đáp án A
Nhiệt phân:
NaNO3→NaNO2+0,5O2(1)
0,05 ← 0,025
2Al(NO3)3→Al2O3+6NO2+1,5O2(2)
Cu(NO3)2→CuO+2NO2+0,5O2(3)
2NO2+0,5O2+H2O→2HNO3
x → 0,25x → x
nO2 dư=0,56/22,4=0,025=nO2(1)
C%HNO3=63x/(46x+0,25x.32+112,5)=0,125=> x=0,25 mol
=> nNO2=0,25 mol; nO2=nO2(2)+nO2(3)+nO2(1)=0,25x+0,025=0,0875 mol
BTKL: mX=mY+mNO2+mO2=10+0,25.46+0,0875.32=24,3 gam
%mNaNO3=0,05.85/24,3=17,49%