Đốt cháy hoàn toàn 5,4g Al. Tính số gam cần dùng để điều chế lượng oxi trên.
Hãy nhập câu hỏi của bạn vào đây, nếu là tài khoản VIP, bạn sẽ được ưu tiên trả lời.


\(n_{Al}=\dfrac{5.4}{27}=0.2\left(mol\right)\)
\(4Al+3O_2\underrightarrow{^{^{t^0}}}2Al_2O_3\)
\(0.2..........0.15\)
\(V_{O_2}=0.15\cdot22.4=3.36\left(l\right)\)
\(2KMnO_4\underrightarrow{^{^{t^0}}}K_2MnO_4+MnO_2+O_2\)
\(0.3...............................................0.15\)
\(m_{KMnO_4}=0.3\cdot158=47.4\left(g\right)\)

\(n_{Al}=\dfrac{5.4}{27}=0,2mol\)
\(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15 0,1
a)\(V_{O_2}=0,15\cdot22,4=3,36l\)
b)\(n_{O_2}=0,15\cdot10\%=0,015mol\)
\(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,03 0,015
\(m_{KMnO_4}=0,03\cdot158=4,74g\)

\(n_{Al}=\dfrac{5,4}{27}=0,2mol\)
\(4Al+3O_2\rightarrow\left(t^o\right)2Al_2O_3\)
0,2 0,15 ( mol )
\(V_{O_2}=0,15.22,4=3,36l\)
\(2KMnO_4\rightarrow\left(t^o\right)K_2MnO_4+MnO_2+O_2\)
0,3 0,15 ( mol )
\(m_{KMnO_4}=0,3.158=47,4g\)
\(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\\
pthh:4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
0,2 0,15
\(V_{O_2}=0,15.22,4=3,36l\\
PTHH:2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
0,3 0,15
\(m_{KMnO_4}=158.0,3=47,4g\)

Có lẽ đề cho "Đốt cháy hoàn toàn 5,4 g Al" bạn nhỉ?
a, PT: \(4Al+3O_2\underrightarrow{t^o}2Al_2O_3\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\)
Theo PT: \(n_{O_2}=\dfrac{3}{4}n_{Al}=0,15\left(mol\right)\)
\(\Rightarrow V_{O_2}=0,15.22,4=3,36\left(l\right)\)
b, PT: \(2KMnO_4\underrightarrow{t^o}K_2MnO_4+MnO_2+O_2\)
Theo PT: \(n_{KMnO_4}=2n_{O_2}=0,3\left(mol\right)\)
\(\Rightarrow m_{KMnO_4}=0,3.158=47,4\left(g\right)\)

PTHH: \(4Al+3O_2\xrightarrow[]{t^o}2Al_2O_3\)
\(2KMnO_4\xrightarrow[]{t^o}K_2MnO_4+MnO_2+O_2\uparrow\)
Ta có: \(n_{Al}=\dfrac{5,4}{27}=0,2\left(mol\right)\) \(\Rightarrow\left\{{}\begin{matrix}n_{O_2}=0,15\left(mol\right)\\n_{KMnO_4}=0,3\left(mol\right)\end{matrix}\right.\) \(\Rightarrow\left\{{}\begin{matrix}V_{O_2}=0,15\cdot22,4=3,36\left(l\right)\\m_{KMnO_4}=0,3\cdot158=47,4\left(g\right)\end{matrix}\right.\)

nAl = 5,4/27 = 0,2 (mol)
PTHH: 4Al + 3O2 -> (t°) 2Al2O3
Mol: 0,2 ---> 0,15
VO2 = 0,15 . 22,4 = 3,36 (l)
PTHH: 2KMnO4 -> (t°) K2MnO4 + MnO2 + O2
nKMnO4 = 0,15 . 2 = 0,3 (mol)
mKMnO4 = 0,3 . 158 = 47,4 (g)

a.\(n_{Cu}=\dfrac{6,4}{64}=0,1mol\)
\(2Cu+O_2\rightarrow\left(t^o\right)2CuO\)
0,1 0,05 ( mol )
\(V_{kk}=\left(0,05.22,4\right).5=5,6l\)
b.\(2KClO_3\rightarrow\left(t^o\right)2KCl+3O_2\)
1/30 0,05 ( mol )
\(m_{KClO_3}=\dfrac{1}{30}.122,5=4,08g\)
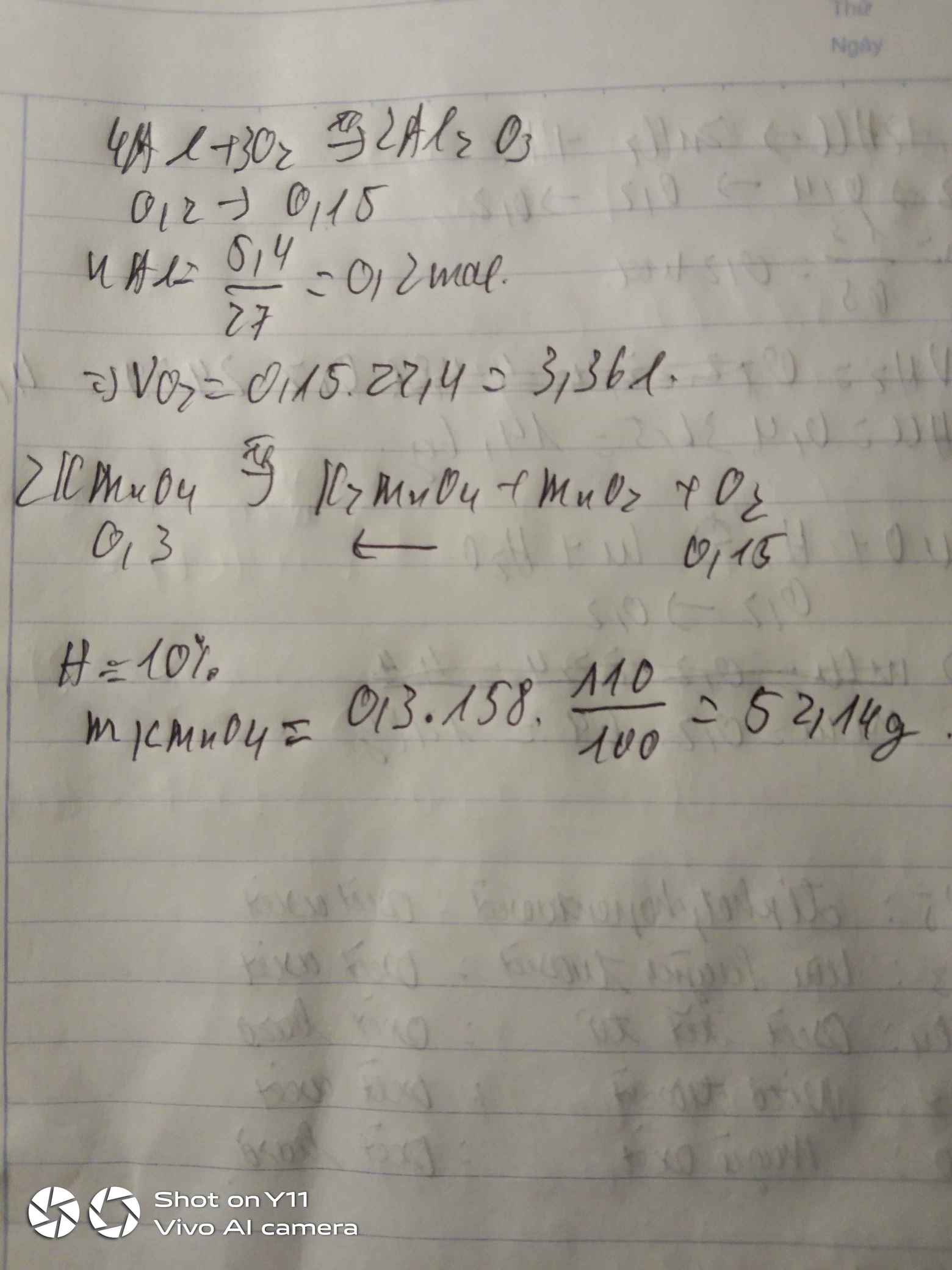
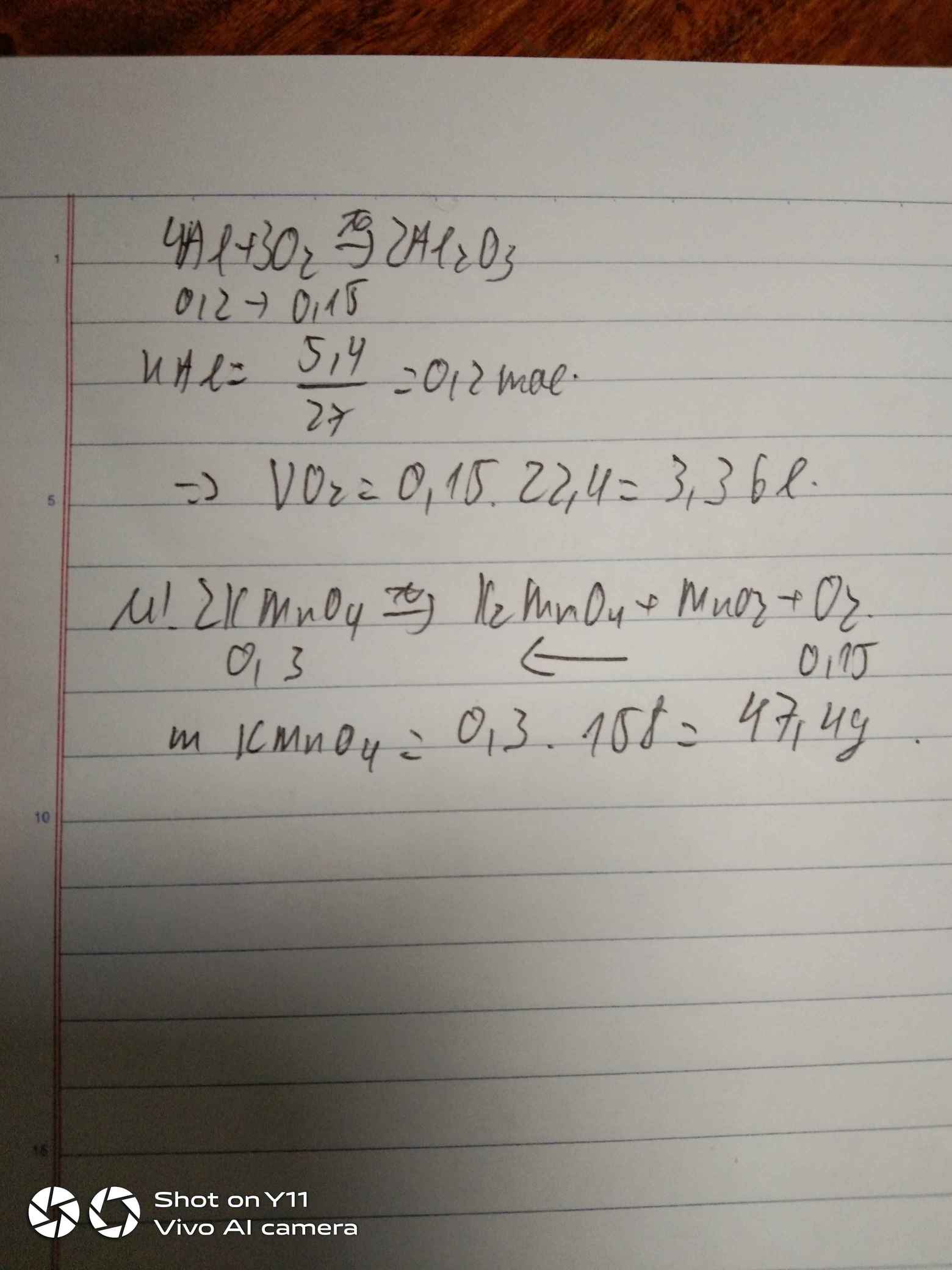
 đó nhé hok tốt
đó nhé hok tốt
Vậy để điều chế 0,15 mol oxi thì cần 47,4g K M n O 4 .